Recentemente foi publicado no JN que o sarampo e a rubéola haviam sido eliminados em Portugal, apesar da utilização correta do conceito epidemiológico nesta caso, muitos jornais afirmaram diferentemente que as doenças haviam sido erradicadas em solo Lusitano. O uso destas expressões causa comoção e impacto popular e reforçam a ação política da saúde pública, abaixo as definições mas precisamente descritas de acordo com o dicionário de epidemiologia de Last:
1)controle: regular, diminuir - quando aplicado à eventos de saúde pública significa a execução de ações ou programas com objetivo de reduzir a incidência e/ou a prevalência destes eventos para se chegar a sua eliminação.
2)Eliminação: Redução da transmissão para um nível predeterminado muito baixo. ex: a eliminação da tuberculose como um problema de saúde pública foi definido pela OMS como a redução da prevalência para um nível inferior a 1 caso por milhão de pessoas. Nesta situação há necessidade de persistência das medidas de controle.
3)Erradicação: término de toda a transmissão pelo extermínio do agente infeccioso por meio da vigilância e contenção. O termo erradicação é absoluto, não admite variação. A erradicação de uma doença somente pode ser considerada quando não são mais necessárias as medidas de controle.
Em alguns documentos há a referência para a erradicação regional, como no caso da poliomielite nas Américas. Este termo é impreciso, pois ainda há necessidade de se manterem as medidas de imunização contra a polio pela possibilidade de importação de casos. No exemplo da notícia supramencionada, em Portugal alcançou-se a eliminação do sarampo e da rubéola, pois ainda há circulação do agente em outros países próximos.
Médico infeciologista. Mestre e Doutor em Medicina Tropical. Autor do Livro Lições de Epidemiologia
terça-feira, setembro 20, 2016
domingo, setembro 18, 2016
Origem do Ensaio Clínico Randomizado - Origins of Randomized Clinical Trial.
É interessante como repetimos conceitos e fatos sem ao menos sabermos como eles se originaram. Esta semana foi publicado na NEJM (link aqui) um interessante histórico de como se estabeleceu a metodologia que apresenta um elevado poder de gerar evidências.
Hoje qualquer medicamento ou intervenção tem que ser testada por meio de ensaios clínicos randomizados, no entanto este delineamento de pesquisa tem origem recente, mais precisamente o primeiro ECR foi realizado em 1948 para teste da estreptomicina no tratamento da tuberculose. A sua evolução se deu em decorrência do desenvolvimento da medicina a partir do fim do século XIX, novas descobertas precisavam ser testadas para avaliar sua utilidade na prática clínica.
Uma estratégia inicial consistia na comparação de grupos alternados, isto é, a separação entre quem iria receber a intervenção e o grupo controle se dava por critérios não aleatórios, o que suscitou questionamentos acerca da validade desta abordagem. Muitos médicos selecionam os pacientes a partir de critérios de gravidade ou mesmo por compaixão.
Em 1931 foi publicado um artigo sugerindo que os pacientes fossem selecionados por meio técnica de lançamento de moedas com o objetivo de criar grupos uniformes. Entretanto, a alocação alternada de pacientes representava o main stream e prevaleceu até meados do século XIX.
Em 1940, Bradford Hill (o mesmo do estudo sobre tabagismo e câncer de pulmão), preocupado com a validade desta metodologia, sugeriu que a alocação alternada fosse substituída pela alocação aleatorizada (randomizada). Em 1962 o congresso americano aprovou a necessidade de se realizar ECR para aprovação de medicamentos por parte do FDA. Desde então o ECR é considerado como padrão.
English Version:
English Version:
It is
interesting how we repeat concepts and facts without even knowing how they have been originated. This week was published in the NEJM (link here) an interesting
history of how the methodology was established that has a high power to
generate evidence.
Today any
drug or intervention has to be tested through randomized clinical trials. However this research design has a
recent origin, more precisely the first RCT was performed in 1948 for the test
of streptomycin in the treatment of tuberculosis. The evolution occurred as a result of the development of medicine
from the end of the nineteenth century; new
discoveries need to be tested to evaluate
its usefulness in clinical practice.
An initial
the strategy was the comparison of alternating groups, that is, the separation
between who would receive the intervention and the control group was based on
non-random criteria, which raised questions about the validity of this
approach. Many doctors select patients from criteria of severity or even
compassion.
In 1931, an
article was published suggesting that patients should be selected through a the coin-throwing technique to create uniform groups. However, alternating patient
allocation represented the mainstream and prevailed until the mid-nineteenth
century.
In 1940, Bradford
Hill (the same as in the study on smoking and lung cancer), concerned about the
validity of this methodology, suggested that alternate allocation is replaced by randomized (randomized)
allocation. In 1962, the US Congress approved the need to conduct ECR for FDA
approval of drugs. Since then ECR is considered the standard.
sábado, maio 14, 2016
Transmissão transfusional do Zika
Zika vírus é um flavivírus descoberto pela primeira vez em 1947. O risco de transmissão transfusional por outros vírus da mesma família é conhecido, principalmente para o dengue e West Nile virus. A transmissão transfusional pelo Zika foi documentada pela primeira vez no Brasil em 2015. Em áreas com transmissão do vírus deve-se estabelecer estratégias no sistema de sangue e hemoderivados de forma a manter os estoques disponíveis para as necessidades dos serviços de saúde.
Medidas recomendadas para se evitar a transmissão transfusional:
1)Em zonas não endêmicas deve-se recomendar que se evite a doação de sangue por período de 14 dias após retorno de área de transmissão e após 28 dias após resolução dos sintomas em pessoas com doenças documentada (mesmo para dengue). No caso de indivíduos que tiveram Zika é também recomendada a aplicação de medidas de inativação viral no sangue doado.
2)Implementação de testagem dos doadores com testes de biologia molecular, esta estratégia encarece o processamento dos hemoderivados e também necessita de equipamentos e técnicos para sua realização, no entanto mostrou-se eficaz durante a epidemia na Polinésia Francesa.
3)Inativação do vírus nos hemoderivados por meio de tratamento com Amatosalen e iluminação com raios UV. Esta estratégia mostrou-se eficaz contra o ZIKV e também contra outros arbovírus.
4)Gestantes só devem receber hemoderivados comprovadamente negativos para ZIKV.
Urbanização da Hantavirose, problema emergente.
Figura - Fonte CDC
A aquisição de hantavirose está relacionada quase exclusivamente à atividade rural, nos períodos de colheita, quando os silos das fazendas se encontram abastecidos e atraem os roedores que se alimentam principalmente dos grãos estocados. O homem adquire a infecção pela inalação de excretas de roedores infectados e o ambiente fechado e privado de iluminação natural favorece a concentração dos aerossóis contaminados, aumentando a possibilidade de aquisição da doença pelo homem. A doença afeta principalmente adultos jovens do sexo masculino. No entanto cada vez mais se detectam casos ligados à transmissão em zonas rurais como recentemente na Província de Azul, na Argentina (Morte de Criança por Hantavirose na Argentina). No Distrito Federal do Brasil também há relatos de casos em áreas periurbanas. Abaixo uma pequena introdução à Hantavirose; adicionalmente sugiro este artigo de revisão para aprofundamento do conhecimento acerca da doença.
A hantavirose é uma doença zoonótica, transmitida ao homem por meio da inalação de excretas de roedores silvestres, amplamente distribuída no Mundo. Na atualidade é considerada doença emergente e constitui importante problema de saúde pública. Nas Américas, a manifestação clínica predominante da doença é Síndrome Pulmonar e Cardiovascular por Hantavírus (SPCVH) .
A doença ganhou reconhecimento
pela medicina ocidental, pela primeira vez, durante a Guerra da Coréia, no
início da década de 50, e se propagou, no ano de 1993, para diversos países da
América. Os primeiros casos da
doença nesse continente foram diagnosticados no ano de 1993, em um surto na
região de Four Corners, no sudoeste
dos Estados Unidos. Atualmente, a virose se encontra distribuída globalmente
atingindo a Europa, a Ásia e as três Américas, sendo que, na América do Sul, os
principais países atingidos são Brasil, Argentina, Chile e Paraguai .
Existem duas
formas clínicas distintas de hantavirose: a Febre Hemorrágica com Síndrome Renal
(FHSR), que ocorre na Ásia e na Europa e possui evolução benigna, e a SPCVH,
forma que ocorre nas Américas e possui alta letalidade. Ambas são doenças
sistêmicas febris que podem acometer diversos órgãos. Na FHSR, o rim é o
principal envolvido, enquanto que na SPCVH os principais órgãos afetados são os
pulmões e o coração .
O agente
causador da hantavirose é o Hantavírus,
um vírus esférico e envelopado de RNA de fita simples, pertencente à família Bunyaviridae. Quatro membros desse
gênero causam FHSR e cerca de duas dezenas causam SPCVH. Cada um deles infecta
roedores específicos e a sua nomenclatura deriva da região onde foi
identificado pela primeira vez .
O Hantavírus é transmitido ao homem por
roedores, principalmente silvestres, de diversos gêneros e espécies, que
abrigam o vírus sem, no entanto, apresentarem a doença. No continente americano
os principais reservatórios são os roedores silvestres da ordem Rodentia, família Muridae e subfamília Sigmodontinae.
Já nos continentes asiático e europeu, os principais roedores envolvidos pertencem
à subfamílias Murinae e Arvicolinae, particularmente aos gêneros
Apodemus e Clethrionomys .
Os
roedores eliminam os vírus na urina, nas fezes e na saliva e a transmissão
ocorre por inalação de aerossóis contendo partículas virais, formados por
ressecamento dessas secreções. Outras formas de transmissão mais raras são:
mordedura de roedores, ingestão de alimentos contaminados com secreções desses
animais e contato com excretas contendo o vírus com posterior introdução em
mucosas. Também foi evidenciada infecção por transmissão interpessoal no Chile
e na Argentina.
quarta-feira, maio 11, 2016
Febre de Oropouche - Oropouche fever
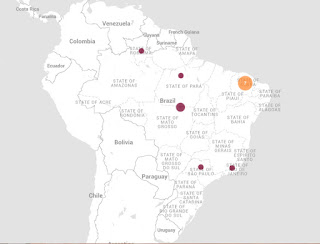
Figura - Regiões das Américas com relato de ocorrência de casos humanos de Febre de Oropouche (fonte: CAD. SAÚDE COLET., RIO DE JANEIRO, 15 (3): 303 - 318, 2007)
A Febre de Oropouche é uma doença viral transmitida por artrópodes. O vírus causador pertence à família Bunyaviridae e o seu transmissor é uma pequena mosca (3 mm) hematófaga Culicoides paraensis (maruim). São insetos encontrados em regiões ribeirinhas e alagadas com abundância de matéria orgânica. Outros vetores também mostraram-se capazes de transmitir a doença, como os mosquitos do gênero Culex e Aedes.
A doença foi descrita pela primeira vez no Pará e depois encontrada em outras regiões do estado do Amazonas. Recentemente um surto foi relatado em cidades do Peru (link: Oropouche em Cusco). No Brasil também já causou surtos no Maranhão (Porto Franco) e em Tocantins (Tocantinópolis) no fim da década de 80. Estudos recentes indicam que o Oropouche pode ser a responsável por mais da metade dos casos de doença febril aguda nas Regiões Amazônicas (principalmente Pará, Norte de Tocantis, Maranhão e Amazonas). Epidemias em vilarejos (zonas urbanas) são frequentes e chamam pouca a atenção das autoridades sanitárias nacionais.
A doença caracteriza-se por período de incubação de 3 a 5 dias com evolução para febre, mialgia, cefaleia, artralgia e fotofobia intensa. A duração dos sintomas costuma ser em média de 3 dias com evolução geralmente benigna, no entanto foram descritos casos com meningite asséptica. O quadro clínico se aproxima muito do observado na dengue, portanto a maior parte dos diagnósticos pode ser erroneamente atribuído à dengue.
O diagnóstico se realiza nomeadamente por meio de exames sorológicos e não há tratamento específico e nem vacinas disponíveis. A grande questão é a potencial capacidade de disseminação deste vírus para regiões mais populosas mais ao sul do Brasil, agregando complexidade ao diagnóstico diferencial e causando mais morbidade à população. A possibilidade de transmissão por mosquitos do gênero Culex e Aedes fortalece a necessidade de vigilância mais estreita aos casos de doença febril aguda em todos os estados brasileiros e países vizinhos.
English Version:
Oropouche
fever is a viral disease transmitted by arthropods. The causative virus belongs
to the family Bunyaviridae, and its
transmitter is a small fly (3 mm) hematophagous Culicoides paraensis (maruím).
They are insects found in Riverside
regions and flooded with an abundance of
organic matter. Other vectors were also able to transmit the disease, such as
the mosquitoes of the genus Culex and Aedes.
The disease
was first described in Brazil in Pará state and later found in other regions of
the state of Amazonas. Recently an outbreak has been reported in Peruvian
cities (link: Oropouche in Cusco). In Brazil, it has also caused outbreaks in
Maranhão (Porto Franco) and Tocantins (Tocantinópolis) in the late 1980s.
Recent studies indicate that Oropouche may be responsible for more than half of
the cases of acute febrile disease in the
Amazonian Regions Pará, North of Tocantins,
Maranhão, and Amazonas). Epidemics in
villages (urban areas) are frequent and draw little attention from national
health authorities.
The disease
is characterized by an incubation period
of 3 to 5 days with evolution to fever, myalgia, headache, arthralgia and
intense photophobia. The duration of the symptoms usually is in an average
of 3 days with generally benign evolution, nevertheless have been described
cases with aseptic meningitis. The
clinical picture is close to that observed in dengue, so most diagnoses can be erroneously
attributed to this virus.
The diagnosis
is made namely through serological tests,
and there is no specific treatment or vaccines available. The major issue is
the potential spread of this virus to more populated regions in southern
Brazil, adding complexity to the differential diagnosis and causing more
morbidity to the population. The possibility of transmission by mosquitoes of
the genus Culex and Aedes strengthens the need for closer surveillance to cases
of acute febrile illness in all Brazilian states and neighboring countries.
segunda-feira, dezembro 28, 2015
Vacina para Dengue é licenciada no Brasil.
Vacina para Dengue é licenciada no Brasil. A empresa Sanofi Pasteur conseguiu licença da vacina pela Anvisa e suas similares no México e na Filipina. Trata-se de uma vacina tetravalente que protege cerca de 60 % dos casos e 80-90 % das formas mais graves. Até o momento está autorizada para uso em pessoas de 9 a 45 anos.
Limitações até o momento:
1)Custo: a dose custa cerca de 20 euros, muito cara levando-se em conta a universalidade da dengue nos países acometidos (só no Bras...il cerca de 200 milhões) e a necessidade de revacinação semestralmente.
2)Idade: crianças menores que 9 anos não poderão neste momento se beneficiar, o que deixa desprevenido um grupo importante de suscetíveis.
3)Baixa eficiência: cerca de 60% nos ensaios.
4)É só para dengue, obviamente não resolve os outros graves problemas relacionados à Zika e ao CHIK.
Apesar destas limitações, já representa um grande avanço no combate à doença e à mortalidade associada.
Limitações até o momento:
1)Custo: a dose custa cerca de 20 euros, muito cara levando-se em conta a universalidade da dengue nos países acometidos (só no Bras...il cerca de 200 milhões) e a necessidade de revacinação semestralmente.
2)Idade: crianças menores que 9 anos não poderão neste momento se beneficiar, o que deixa desprevenido um grupo importante de suscetíveis.
3)Baixa eficiência: cerca de 60% nos ensaios.
4)É só para dengue, obviamente não resolve os outros graves problemas relacionados à Zika e ao CHIK.
Apesar destas limitações, já representa um grande avanço no combate à doença e à mortalidade associada.
quinta-feira, novembro 05, 2015
O Futuro da Saúde Pública
Agimos de forma intuitiva durante o nosso dia-a-dia, às vezes a reflexão é uma boa oportunidade de avaliarmos acerca do rumo que tomamos profissionalmente e para podermos estabelecer novas metas para a nossa vida profissional. O profissional que atua na saúde pública nos últimos tempos teve que parar certamente por muitas vezes dadas as mudanças constantes no cenário da área. A minha proposta neste post é mesmo propor esta reflexão partir de um excelente artigo publicado na NEJM recentemente (link aqui).
A principal função da Saúde Pública é estabelecer intervenções que possam beneficiar as pessoas. A tomada de decisões deve ser feita a partir de evidências a busca da descrição dos determinantes e da realidade da população são as bases para se alcançar as melhores evidências. Quais são os problemas que mais afetam a população mundial no momento? e quais as ações que são mais efetivas no alcance deste objetivo?
O artigo começa com uma ilustração muito interessante, uma pirâmide cuja a base representa a situação social e econômica da população. Esta é a ação que tem o maior impacto e o menor custo, portanto fornecer os meios dos indivíduos se desenvolverem economicamente é a melhor estratégia, muito distante das nossas ações diárias não é? . Ao subirmos para o próximo nível da pirâmide, as ações da saúde pública são mais evidentes, a mudança de determinantes que tenham impacto em toda a população, como o fornecimento de água potável, vigilância de produtos para o consumo etc. Mais acima as ações que têm longa duração, mas que englobam somente grupos específicos da população como a imunização. Mais acima o atendimento clínico das doenças e por último, no topo da pirâmide e com menor abrangência sobre as pessoas, a educação e aconselhamento.
A primeira etapa para a melhoria da situação de saúde de uma população é a melhoria da sua situação econômica e social (isto inclui educação, renda, moradia, transporte etc.). Esta é a abordagem mais barata e efetiva, e a omissão dos governos nesta parcela é gritante. Como podemos controlar a dengue, tendo como exemplo esta doença que inferniza os trópicos, se as condições de moradia e urbanização das grandes cidades de países em desenvolvimento ainda apresenta enorme precarização?
Vou dedicar-me mais ao artigo em postagens a frente. Há muito que discutir sobre o futuro da saúde pública.
quarta-feira, setembro 23, 2015
KPC: um desafio para o controle
Figura - Distribuição da KPC e suas variantes no Mundo (2013 - Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases, Price et al. Lancet)
A KPC (Klebsiella pneumoniae Carbapenemase) é uma beta lactamase capaz de hidrolisar a totalidade dos antibióticos beta lactâmicos, inclusive os carbapenemas e substâncias inibidoras da beta lactamase. O termo KPC gera confusão e é pouco preciso, já que esta enzima pode ser detectada em outras enterobactérias, como as do gênero Pseudomonas. Recentemente o CDC cunhou a denominação CPE ( Enterobactérias Produtoras de Carbapenemase), sendo, portanto, este termo mais preciso.
Surtos de infecção por K.pneumoniae KPC são descritos em diversos países e com padrão endêmico em alguns como os EUA e o Brasil. A proporção de bactérias KPCs isoladas em hospitais também vem crescendo, em 2011 era de 12 %, em 2012 65 % e em 2013 57 %. A letalidade também é maior em comparação com pacientes infectados por bactérias sensíveis, o excesso de letalidade chega a 20 %. A letalidade chega a 48 % dos pacientes diagnosticados com infecção da corrente circulatória.
Para o tratamento destas bactérias restam poucas opções, entre elas a colistina, gentamicina e tigeciclina. Usadas isoladamente ou em diferentes associações. Nenhuma destas opções é ideal. A colistina e a gentamicina são nefrotóxicas e sua combinação pode levar a quadros de insuficiência renal. A tigeciclina tem ação errática, portanto gera pouca confiança na sua utilização em pacientes graves. Para piorar já se detectam bactérias resistentes à colistina e o lançamento de novas drogas não acompanha a rapidez da geração de resistência. Recentemente foi lançado nos EUA a ceftazidima-avibactam, uma combinação que se mostra ativa contra a KPC, no entanto há relatos de rápida criação de resistência.
O controle ainda se dá pela identificação precoce da colonização (geralmente ocorre em até 4 8 h após a internação) e a separação dos pacientes detectados colonizados. Talvez seja este um dos maires problemas relacionados à assistência hospitalar, a falta de opções minimamente ideais e a gravidade dos casos torna um grande problema para médicos e gestores.
A KPC (Klebsiella pneumoniae Carbapenemase) é uma beta lactamase capaz de hidrolisar a totalidade dos antibióticos beta lactâmicos, inclusive os carbapenemas e substâncias inibidoras da beta lactamase. O termo KPC gera confusão e é pouco preciso, já que esta enzima pode ser detectada em outras enterobactérias, como as do gênero Pseudomonas. Recentemente o CDC cunhou a denominação CPE ( Enterobactérias Produtoras de Carbapenemase), sendo, portanto, este termo mais preciso.
Surtos de infecção por K.pneumoniae KPC são descritos em diversos países e com padrão endêmico em alguns como os EUA e o Brasil. A proporção de bactérias KPCs isoladas em hospitais também vem crescendo, em 2011 era de 12 %, em 2012 65 % e em 2013 57 %. A letalidade também é maior em comparação com pacientes infectados por bactérias sensíveis, o excesso de letalidade chega a 20 %. A letalidade chega a 48 % dos pacientes diagnosticados com infecção da corrente circulatória.
Para o tratamento destas bactérias restam poucas opções, entre elas a colistina, gentamicina e tigeciclina. Usadas isoladamente ou em diferentes associações. Nenhuma destas opções é ideal. A colistina e a gentamicina são nefrotóxicas e sua combinação pode levar a quadros de insuficiência renal. A tigeciclina tem ação errática, portanto gera pouca confiança na sua utilização em pacientes graves. Para piorar já se detectam bactérias resistentes à colistina e o lançamento de novas drogas não acompanha a rapidez da geração de resistência. Recentemente foi lançado nos EUA a ceftazidima-avibactam, uma combinação que se mostra ativa contra a KPC, no entanto há relatos de rápida criação de resistência.
O controle ainda se dá pela identificação precoce da colonização (geralmente ocorre em até 4 8 h após a internação) e a separação dos pacientes detectados colonizados. Talvez seja este um dos maires problemas relacionados à assistência hospitalar, a falta de opções minimamente ideais e a gravidade dos casos torna um grande problema para médicos e gestores.
quinta-feira, agosto 13, 2015
Chikungunya na Espanha
Figura - Localização de Gandia - Espanha.
No dia 03 de agosto deste ano foi detectado na cidade de Gandia na Espanha (próximo a Valencia) um caso de CHIK não associado à viagem a países endêmicos. A cidade de Gandia se localiza na costa mediterrânea da Espanha uma área em que há infestação de Aedes albopictus estabelecida (link) . Trata-se de um paciente de 60 anos que se encontrava anteriormente ao diagnóstico no sul da França ( Região de Languedoc-Roussillon, onde o mosquito também está presente). A sorologia foi positiva (IgM) e o paciente apresentava sintomas da doença.
Esse evento representa grave risco de disseminação da transmissão da doença nesta área, que apresenta as condições necessárias para o estabelecimento de epidemia dado que a Europa se encontra em pleno verão. Não há como prever o que vai acontecer, mas pode ser o estopim para uma situação epidemiológica preocupante.
Link para o alerta da OMS.
No dia 03 de agosto deste ano foi detectado na cidade de Gandia na Espanha (próximo a Valencia) um caso de CHIK não associado à viagem a países endêmicos. A cidade de Gandia se localiza na costa mediterrânea da Espanha uma área em que há infestação de Aedes albopictus estabelecida (link) . Trata-se de um paciente de 60 anos que se encontrava anteriormente ao diagnóstico no sul da França ( Região de Languedoc-Roussillon, onde o mosquito também está presente). A sorologia foi positiva (IgM) e o paciente apresentava sintomas da doença.
Esse evento representa grave risco de disseminação da transmissão da doença nesta área, que apresenta as condições necessárias para o estabelecimento de epidemia dado que a Europa se encontra em pleno verão. Não há como prever o que vai acontecer, mas pode ser o estopim para uma situação epidemiológica preocupante.
Link para o alerta da OMS.
sexta-feira, julho 31, 2015
Morcegos como reservatórios da Leishmaniose
Os posts tornaram-se mais escassos, pois estou extremamente concentrado em terminar alguns artigos sobre leishmaniose visceral, mas esse artigo eu achei interessante para comentar aqui no blog. A leishmaniose é uma doença causada por um protozoário que parasita os macrófagos dos mamíferos. Tem um ciclo complexo com reservatórios animais e vetores alados. Reservatórios silvestres como a raposa e marsupiais e doméstico como o cão são bem estabelecidos na dinâmica, todavia de vez em quando aparece uma nova evidência de que outros animais estariam envolvidos.
Nesse artigo de Oliveira e colaboradores que foi publicado essa semana na Acta Tropica é interessante, pois traz como evidência a observação que cerca de 17 % dos morcegos urbanos em uma cidade endêmica para leishmaniose se encontram infectados por L. infantum. Sabe-se também que os flebotomíneos podem também se alimentar do sangue desses animais. Essa descrição é muito intrigante e preocupante ao mesmo tempo. Mais um reservatório representa aumento da complexidade da execução de medidas de controle da doença e pode realmente inviabilizar a perspectiva de intervenção da saúde pública neste elo da cadeia. Também pode ajudar a explicar a mudança epidemiológica da doença nestas últimas décadas no Brasil, os morcegos são extremamente bem adaptados ao ambiente urbano e contam com uma grande população em praticamente todas as cidades.
Agora é aguardar outros estudos que se proponham a ligar os morcegos à transmissão da doença humana.
Link para o artigo: aqui
sábado, junho 27, 2015
Zika vírus no Brasil - qual situação atual?
Mapa do Promed com os casos de Zika no Brasil no último mês.
O ZIKV foi descoberto na década de 40 em uma floresta de Uganda, chamada Zika. O isolamento do vírus se deu de forma inesperada, pois estava-se fazendo pesquisas para a febre amarela com macacos sentinela presos nas copas das árvores. Desde então a doença disseminou-se pela África e pela Ásia. Em 2007 foi detectado um grande surto nas Ilhas do Oceano Pacífico. Neste ano isolou-se a doença no Brasil.
De acordo com fontes informais, só na Bahia já foram detectados mais de 20.000 casos suspeitos em mais de 160 municípios. Felizmente a doença é benigna, mas pode atrapalhar o diagnóstico com a dengue e tem sido associada ao aumento de casos de Síndrome de Guillain Barré. Outro problema também é na dificuldade de diagnóstico, ainda não há um kit comercial disponível.
Os casos que tenho notícia se caracterizam por febre baixa, prostração que evoluiu para exantema maculopapular em face que progride para o resto do corpo, inclusive palmas e solas. Duas características importantes é que o exantema é pruriginoso e a presença de conjuntivite intensa e sem pus.
domingo, junho 07, 2015
Breve Revisão acerca da doença por Zika Virus
Distribuição do Zika vírus .
O Zika Virus é um flavivírus relacionado à Febre Amarela e o Dengue e transmitido por vetores artrópodes (arbovirose). Foi isolado pela primeira vez na Uganda, na floresta de Zika em 1947. É endêmica no leste e oste da África já tendo sio detectado em surtos no Sudeste Asiático, Micronésia e Oceania. Foi reportado pela primeira vez nas Américas em 2014 na Ilha de Páscoa (território Chileno no Oceano Pacífico) provavelmente relacionado ao surto na Micronésia. Em 2015, casos foram confirmados na Região Sudeste e Nordeste do Brasil.O vírus é transmitido por mosquitos do gênero Aedes sp. Até o momento não foram descritos reservatórios animais do vírus. Clinicamente é caracterizada por febre de inicio agudo acompanhada de cefaleia discreta, no segundo dia da doença surge exantema maculopapular acometendo face, troncos, membros, palmas e solas. A febre cede um dia ou dois após o aparecimento do exantema, que persiste por mais alguns dias. São relatadas dores articulares discretas e dor lombar. Outras manifestações inespecíficas como anorexia, náuseas e vômitos podem ocorrer.É relatado também em alguns casos conjuntivite.
O diagnóstico diferencial se faz principalmente com dengue, chikungunya e outras doenças febris agudas como malária, leptospirose. Deve-se pensar também em doenças como artrite reativa e farmacodermia.
O diagnóstico pode ser realizado por meio de PCR até 11 dias de evolução da doença. Anticorpos IgM podem ser detectados a partir do terceiro dia de doença. Anticorpos IgG devem ser investigados no soro agudo e convalescente (sorologia pareada).
Não existe vacina e nem drogas antivirais específicas, o tratamento é sintomático com analgésicos e antitérmicos. Deve-se evitar o uso de aspirina (salicilatos), nomeadamente em territórios com circulação concomitante do vírus da dengue pela possibilidade de agravar o quadro em pacientes com essa doença. Até o momento não foi relatado nenhum óbito pela doença.
Medidas de Saúde Pública devem visar medidas contra o vetor, tanto coletivas quanto individuais. Nos locais em que o vírus ainda não esteja totalmente estabelecido, deve-se isolar os indivíduos infectados e evitar que eles tenham contacto com o vetor.
Ainda são desconhecidos vários aspectos da epidemiologia do Zika virus. Novos estudos com intuito de se investigar a dinâmica de transmissão da vírus poderão auxiliar na definição de fatores que possam contribuir para a formação de endemia nas regiões recentemente acometidas. Até lá, as medidas de controle vetorial devem ser intensificadas e muito cuidado deve-se ter em relação ao manejo do paciente, nomeadamente para se evitar o aumento dos casos de óbitos ocasionados pela dengue em decorrência de diagnósticos equivocados.
terça-feira, junho 02, 2015
MERS-CoV: doença emergente com alta letalidade
Figura - Países acometidos pelo MERS-CoV
A transmissão do vírus, um coronavírus, se dá por meio de gotículas respiratórias e contato íntimo com pessoas infectadas. A doença é considerada uma zoonose e a fonte são camelos (dromedário). Até o momento, todos os casos autóctones ocorreram em países da península arábica (listados acima). Casos importados já foram detectados em países da Europa e dos EUA.
O vírus tem predilecção por receptores DPP4 presentes abundantemente em células do pulmão (alvéolos e brônquios), alguns órgãos hematopoéticos, rins, intestino e fígado. O que explica a capacidade de disseminação do vírus pelo organismo.
O quadro clínico caracteriza-se por início de febre acompanhada de tosse, e dispneia após um período de incubação de 5 a 12 dias. A doença evolui para insuficiência respiratória e insuficiência múltipla de órgãos. Cerca de 3 a 4 em 10 indivíduos com o quadro grave falece, a maioria apresenta algum tipo de comorbidade. A doença também pode se manifestar com sintomas respiratórios leves.
Ainda não há vacinas e nem tratamento específico, portanto as medidas de detecção precoce de casos e de isolamento devem ser implementadas pelas vigilâncias de todos os países com especial atenção às pessoas oriundas das áreas com transmissão activa da doença.
Actualização:
Até Dezembro de 2019 foram notificados 2499 casos com 858 mortes. A boa notícia é que a vacina para esta infecção já foi desenvolvida e se mostrou promissora em ensaio clínico. Conclusão do estudo (link abaixo):
" The GLS-5300 MERS coronavirus vaccine was well tolerated with no vaccine-associated serious adverse events. Immune responses were dose-independent, detected in more than 85% of participants after two vaccinations, and durable through 1 year of follow-up. The data support further development of the GLS-5300 vaccine, including additional studies to test the efficacy of GLS-5300 in a region endemic for MERS coronavirus."
Ainda não há vacina disponível para o MERS-CoV no mercado e a doença continua em actividade, já tendo sido detectada em 27 países. A maiorida dos casos continua na Arábia Saudita.
Links úteis:
Link do CDC
Página do MERS-CoV na OMS
Ensaio clínico da vacina - Lancet
Plasmódio knowlesi é reponsável por 66% dos casos de Malária na Malásia
Figura - Macaca fascicularis ou macaco-cinomolgo, macaco do Sudeste Asiático associado com os casos da doença.
Em 1965 o primeiro caso de infeção por Plasmodium knowlesi foi detectado em um americano que a contraiu durante uma passagem por florestas da Malásia. Este parasito é encontrado naturalmente infectando primatas no sudeste asiático, a infecção humana adquirida naturalmente era considerada rara. Em 2004 um grande surto em seres humanos foi detectado em Sarawak, Bornéu Malasiano, desde então o P. knowlesi é considerado a quinta espécie de plasmódio parasita de homens. Atualmente, o governo da Malásia afirmou que dos 3923 casos detectados em 2014, 66 % foram causados pelo P. knowlesi, ou seja, a maioria dos casos.
Há mais de 150 espécies de parasitos causadores de malária, a maioria é espécie específico e somente quatro eram associados à casos humanos. O P. malarie é o parasito mais difícil de se encontrar causando doença em humanos, todavia vinha sendo frequentemente sendo detectado em pacientes da Malásia causando formas graves de malária. Por meio de técnicas de PCR, foi constatado que se tratava na realidade de P.knowlesi, indistinguível do malarie por meio de microscopia.
A principal preocupação é que o agente se adapte ao ser humano e que se espalhe por outras áreas endêmicas da doença, o que é mais preocupante é que está associada à formas graves de malária. |Ainda há muitas dúvidas, as teorias para esta adaptação envolvem à mudanças do comportamento do vetor (Anopheles leucosphyrus), que passou a preferir o repasto sanguíneo em seres humanos em decorrência do desflorestamento e mudança de habitat de macacos, anteriormente os alvos preferenciais dos mosquitos.
Resistência aos derivados da artemisina - P. falciparum
A malária é uma das doenças que mais causam mortes no mundo, o objetivo é diminuir a mortalidade e os consequentes impactos na sociedade. Nos últimos 15 anos houve um grande avanço neste objetivo com a redução de 42 % dos óbitos. Atualmente a a terapia combinada com esquemas contendo derivados da artemisina é a principal estratégia para o tratamento da malária por P. falciparum em decorrência da resistência deste parasito à outros fármacos.
A detecção precoce e o tratamento correto são essenciais para evitar a resistência, apesar dos esforços continua a ser um problema, principalmente no Sudeste Asiático, onde vem sendo observado o surgimento de perfis de resistência que posteriormente se disseminam para outras regiões. Diante disso, é importante acompanhar "as novidades" que ocorrem nesta região.
Recentemente, um artigo publicado no Lancet Infect Dis, traz a observação de resistência clínica associada à um gene no P, falciparum a combinação de Dihidroartemisina- Piperaquina no Camboja. Uma coorte demonstrou que esta combinação (ACT - artemisine combination therapy) se mostrou com um risco de 5.4 maior de falência e se associava a uma tripla mutação.
Do ponto de vista sanitário, essa resistência é extremamente preocupante, já que esta combinação é uma das poucas que se mostram efetivas na região. Outras alternativas incluem a combinação de três drogas, mais caras e com maior incidência de efeitos colaterais. As únicas medidas que podem retardar o aparecimento de resistência incluem o uso correto do medicamente, diagnóstico precoce, o controle vetorial e a melhoria das condições sanitárias.
Link para o artigo - aqui
A detecção precoce e o tratamento correto são essenciais para evitar a resistência, apesar dos esforços continua a ser um problema, principalmente no Sudeste Asiático, onde vem sendo observado o surgimento de perfis de resistência que posteriormente se disseminam para outras regiões. Diante disso, é importante acompanhar "as novidades" que ocorrem nesta região.
Recentemente, um artigo publicado no Lancet Infect Dis, traz a observação de resistência clínica associada à um gene no P, falciparum a combinação de Dihidroartemisina- Piperaquina no Camboja. Uma coorte demonstrou que esta combinação (ACT - artemisine combination therapy) se mostrou com um risco de 5.4 maior de falência e se associava a uma tripla mutação.
Do ponto de vista sanitário, essa resistência é extremamente preocupante, já que esta combinação é uma das poucas que se mostram efetivas na região. Outras alternativas incluem a combinação de três drogas, mais caras e com maior incidência de efeitos colaterais. As únicas medidas que podem retardar o aparecimento de resistência incluem o uso correto do medicamente, diagnóstico precoce, o controle vetorial e a melhoria das condições sanitárias.
Link para o artigo - aqui
quinta-feira, maio 14, 2015
Diagnóstico do Chikungunya - Atualização
Vírus do CHIK isolado de humanos pela Fundação Oswaldo Cruz - Brasil.
Podemos perceber, pelo exposto, a importância do diagnóstico de CHIK e sua diferenciação de outras febres tropicais, nomeadamente a dengue. A disponibilidade dos kits de diagnóstico vem aumentando, todavia ainda há limitações, principalmente pela grande quantidade de doentes observados em uma epidemia. Portanto, o diagnóstico clínico é a principal ferramenta. Recentemente, pesquisadores das forças armadas americanas (US Army) descobriram um teste rápido para detecção do vírus de forma rápida em pools de insetos. É uma estratégia para a vigilância entomológica e pode ser um avanço futuro no diagnóstico em seres humanos (Link para o artigo).
As técnicas laboratoriais disponíveis agora são as seguintes:
1)Cultura viral - disponível em laboratórios de pesquisa, deve ser feita até 3 dias do início dos sintomas (período de viremia)
2)RT - PCR - disponibilidade limitada pelo custo e pela necessidade de pessoal e equipamento de maior custo, deve ser feita até 8 dias do início dos sintomas.
3)Detecção de anticorpos IgM por técnica imunoenzimática - teste mais disponível e capaz de detectar casos agudos, sua positividade se inicia a partir do quarto dia de doença.
4)Detecção de IgG - deve ser feita por meio de duas amostras (fase aguda e convalescência) para se avaliar o aumento de até quatro títulos de anticorpos séricos contra o vírus.
Vários Kits diagnóstico estão em fase de desenvolvimento e aprovação para uso clínico, enquanto isso deve-se contactar os agentes de saúde pública locais para informações acerca da disponibilidade dos exames e dos protocolos de aplicação.
No Brasil, o Ministério da Saúde publicou os seguintes documentos (links):
-Preparação e Resposta à Introdução do Vírus Chikungunya no Brasil
-CLASSIFICAÇÃO DE RISCO E MANEJO DO PACIENTE COM SUSPEITA DE CHIKUNGUNYA (FASE AGUDA)
-Febre de Chikungunya - Manejo Clínico
segunda-feira, maio 11, 2015
Dilemas morais e bioéticos
Foto do sítio bioethics.com
Atualmente, cada vez mais, a humanidade tem se deparado com esses dilemas. Um exemplo mais recente é o surto de ebola no oeste africano. A descoberta e o uso de novos medicamentos poderia salvar milhares de vidas, mas o preço a se pagar pelos excessos cometidos no passado e pelo avanço das novos delineamentos é a demora da sua liberação para uso clínico. Um artigo de opinião do Dr. Arthur Kaplan no Lancete desta semana levanta essa questão para discussão. Abaixo segue o link para a publicação:
quinta-feira, abril 30, 2015
O Zika passou o CHIK
Figura - Distribuição do ZIKA no Mundo.
Todos esperávamos uma grande epidemia de CHIK no Brasil este ano, mas outra arbovirose está a se disseminar de forma rápida, nomeadamente no nordeste do Brasil. Trata-se da Febre do Zika, uma arbovirose transmitida pelo Aedes sp. e que é originária da África e da Ásia. Pesquisadores de uma Universidade da Bahia isolaram o vírus de casos de uma doença exantemática que se espalhou por Salvador e Região Metropolitana e que também vem a ser relatada em outros estados circunvizinhos. Acredita-se que o vírus tenha entrado no Brasil durante o mundial de futebol ocorrido em 2014.
Trata-se de um flavivírus que causa doença benigna caracterizada por inicio agudo de febre, exantema maculopapular (geralmente inicia-se na face e se dissemina pelo restante do corpo) e artralgia nomeadamente nas pequenas articulações do membro superior. Conjuntivite também é relatada. Os sinais e sintomas são leves e moderados de evolução auto limitada de cerca de 2 a 7 dias. O diagnóstico pode ser feito por meio de sorologia (IgM positiva - pode haver reação cruzada com outros flavivírus) e RT - PCR. Não há tratamento específico, sendo recomendados os analgésicos. Como no Brasil há possibilidade de dengue, evitar a aspirina e os anti-inflamatórios não esteroidais.
O diagnóstico diferencial é amplo considerando-se os agentes que circulam no país, inclusive a doença estava a ser confundida com a doença exantemática causada por parvovírus B19. Felizmente essa doença não se mostrou complicada, apesar de haver poucos casos envolvendo gestantes e recém-nascidos.
A prevenção reside nas velhas orientações de se evitar contato com mosquitos, crianças muito pequenas não podem usar repelente, portanto o cuidado com o domicilio é essencial. Ainda há que se aguardar o término das investigações epidemiológicas para poder ser afirmar que há de fato uma epidemia da doença no Brasil.
Todos esperávamos uma grande epidemia de CHIK no Brasil este ano, mas outra arbovirose está a se disseminar de forma rápida, nomeadamente no nordeste do Brasil. Trata-se da Febre do Zika, uma arbovirose transmitida pelo Aedes sp. e que é originária da África e da Ásia. Pesquisadores de uma Universidade da Bahia isolaram o vírus de casos de uma doença exantemática que se espalhou por Salvador e Região Metropolitana e que também vem a ser relatada em outros estados circunvizinhos. Acredita-se que o vírus tenha entrado no Brasil durante o mundial de futebol ocorrido em 2014.
Trata-se de um flavivírus que causa doença benigna caracterizada por inicio agudo de febre, exantema maculopapular (geralmente inicia-se na face e se dissemina pelo restante do corpo) e artralgia nomeadamente nas pequenas articulações do membro superior. Conjuntivite também é relatada. Os sinais e sintomas são leves e moderados de evolução auto limitada de cerca de 2 a 7 dias. O diagnóstico pode ser feito por meio de sorologia (IgM positiva - pode haver reação cruzada com outros flavivírus) e RT - PCR. Não há tratamento específico, sendo recomendados os analgésicos. Como no Brasil há possibilidade de dengue, evitar a aspirina e os anti-inflamatórios não esteroidais.
O diagnóstico diferencial é amplo considerando-se os agentes que circulam no país, inclusive a doença estava a ser confundida com a doença exantemática causada por parvovírus B19. Felizmente essa doença não se mostrou complicada, apesar de haver poucos casos envolvendo gestantes e recém-nascidos.
A prevenção reside nas velhas orientações de se evitar contato com mosquitos, crianças muito pequenas não podem usar repelente, portanto o cuidado com o domicilio é essencial. Ainda há que se aguardar o término das investigações epidemiológicas para poder ser afirmar que há de fato uma epidemia da doença no Brasil.
segunda-feira, abril 06, 2015
Diarreia do Viajante
Em um mundo cada vez mais conectado e onde se pode atravessar todo o globo em menos de 24 h, as viagens vêm se tornando algo cada dia mais corriqueiro. Estima-se que em 2030 haverá cerca de 1 a 8 bilhões de turistas viajando pelo mundo anualmente. A diarreia do viajante é um dos maiores problemas que enfrentam os viajantes, cerca de 30 a 40 % dos que fazem uma viagem por qualquer motivo adquirem esta condição, que na maior parte das vezes é benigna.
Medidas de Prevenção:
1-Seleção da Alimentação - evitar alimentos crus e comida de rua, gelo, frutas com casca. As bebidas engarrafadas são mais seguras, de maneira geral os produtos industrializados.
2-Higiene das mãos - usar álcool em gel em sítios onde não haja dispositivos sanitários.
3-Ter conhecimento dos sintomas e estar preparado para intervir com a medicação prescrita na consulta de pré-viagem.
4-Tratamento da água -- falarei em um post específico.
5-Vacinação - também em post específico.
Em janeiro de 2015, o Jama publicou uma revisão acerca do assunto, o objetivo foi reunir as melhores evidências disponíveis sobre a etiologia, tratamento e medidas de prevenção. Eu fiz uma apresentação no Prezi, tentei resumir os pontos mais importantes apresentados no artigo. Quem tiver interesse pode aceder ao link abaixo:
Apresentação Prezi.
Abaixo o link para o sítio do artigo (free):
Artigo Jama Diarreia do Viajante.
sábado, abril 04, 2015
Aedes sp. um vetor a se adaptar: uma ameaça real para os países de clima temperado
A expansão dos mosquitos do gênero Aedes, transmissor de doenças febris entre elas a dengue, a Febre Amarela e o Chikungunya, tem sido a grande preocupação das autoridades sanitárias nos últimos anos. Vou comentar brevemente dois episódios recentes que demonstram o risco de expansão dessas doenças para territórios que o mosquito nunca existiu ou havia sido controlado.
Recentemente foi detectado uma epidemia de dengue na Ilha da Madeira, essa região é um território autônomo de Portugal com cerca de 260.000 habitantes, apresentando clima temperado mediterrâneo. Em 2005 foi encontrado o Aedes aegypti pela primeira vez em uma das ilhas do arquipélago. Em 2012 foram detectados os primeiros casos de dengue do tipo DEN 1. Foram um total de 2168 casos (entre prováveis e confirmados). Esse episódio gera muitas preocupações, apesar de Portugal continental não ter o Aedes aegypti em seu território, o Aedes albopictus infesta diversas regiões de clima temperado da Europa, e também por já ter havido epidemias de dengue anteriormente, sendo a última em 1928 na Grécia.
O primeiro caso de Chikungunya nas Américas ocorreu em Dezembro de 2013 nas Antilhas, desde então a doença se espalhou por diversos países do continente já alcançando a cifra de 1.300,000 casos. A grande novidade é a ocorrência de casos autóctones nos EUA, especificamente na Flórida, demonstrando a grande capacidade de adaptação do mosquito Aedes. A situação pode piorar com a reemergência de casos de dengue no Texas e a possibilidade de epidemias da doença em outros estados. Abaixo a distribuição de Aedes nos EUA de acordo com o CDC:
Para finalizar é bom lembrar que o CHIK e a dengue são doenças relativamente benignas, apresentando baixa letalidade. Todavia, uma doença que se encontra nas Américas há longa data e que tem o potencial de causar até 25 % de letalidade, a Febre Amarela, é também transmitida pelos mesmos vetores. E para quem nunca ouviu falar, Lisboa teve uma epidemia de FA em 1857 com 16.000 casos (10 % da população lisboeta na época) e 5.000 mortes. José saramago, em seu livro Memorial do Convento, relata:
"(...) está Lisboa atormentada de uma grande doença, morrem pessoas em todo as casas (...). Que doença é essa, dizem que foi trazida por uma nau do Brasil, (...) mas, sobre a doença, pelos sinais que dá, é vómito negro ou febre-amarela, e o nome importa pouco, o caso é que estão morrendo como tordos (...). "
Subscrever:
Comentários (Atom)
Origem da Quarentena - Quarantine origin
Em meados do século XIV, autoridades sanitárias da Itália, sul da França e arredores, premidos pela epidemia de peste negra, criaram um sist...
-
Muito se tem falado atualmente acerca do comportamento de uma epidemia. Principalmente pelo interesse e comoção social que se tem observado...
-
Figura - Regiões das Américas com relato de ocorrência de casos humanos de Febre de Oropouche (fonte: CAD. SAÚDE COLET., RIO DE JANEIRO, ...
-
A pandemia da doença causada pelo SARS CoV 2 iniciou-se na China, na cidade de Wuhan, com os primeiros casos detectados em Dezembro de 2019....