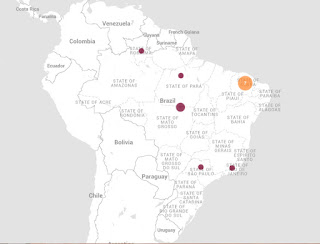
Os coronavírus são patógenos causadores de infecções das vias respiratórias, são transmitidos entre humanos e animais. São causadores de cerca de 1/3 das infecções respiratórias superiores em epidemias. Podem também estar envolvidos em quadros de insuficiência respiratória.
São vírus RNA e têm o aspecto de uma coroa quando observados em microscopia eletrônica, daí derivando o seu nome -- Corona (coroa). O coronavírus vem sendo associado às seguintes formas de doença:
1- Coronavírus humanos (HCoV) - causam infecções em seres humanos, são úbiquos circulam de forma sazonal em climas temperados, muito embora possam ser transmitidos durante todo o ano. Geralmente causam manifestações do tipo resfriado comum autolimitadas.
2-SARS CoV - causador da doença identificada em fevereiro de 2003 na província de Guangdong na China e que se manifesta clínicamente como uma infecção respiratória rapidamente progressiva para insuficiência respiratória, sendo o cunhado o termo para esta condição de Síndrome Respiratória Aguda Grave (SRAG em português). Foram identificados 8096 casos com 774 mortes e letalidade de 9.6 %. A transmissão de SARS foi considerada como controlada.
3-MERS-CoV - também se trata de um quadro de infecção respiratória aguda que rapidamente evolui para insuficiência respiratória e insuficiência renal. Foi identificado pela primeira vez na Arábia Saudita (daí o nome Síndrome Respiratória do Médio Oriente) no ano de 2012 e já causou cerca de 2400 casos confirmados laboratorialmente (metada foi detctada em profissionais de saúde), podendo haver mais casos. Esta doença teve como fonte provável os dromedários; a transmissão inter-humana confirmada. Esta infecção ainda se encontra em vigilância e a letalidade apresentada chegou a 40 %.
4-SARS CoV-2 (COVID-19) - os primeiros casos foram detectados em dezembro de 2019 na cidade de Wuhan, a city in the Hubei Province of China. Desde então mais de 120 mil casos foram notificados no mundo. Estes números fizeram com que a OMS decretasse emergência internacional de saúde pública em fevereiro de 2020 e pandemia em março. Trata-se de uma infecção respiratória que pode evoluir para insuficiência respiratória grave em pacientes idosos (acima de 60 anos) ou com comorbidades. A doença é assintomática ou leve em cerca de 90 % dos casos. O suporte ventilatório é necessário em 10 % e ventilação mecânica em 1 %. Atualmente a letalidade média estimada é de cerca de 2 a 4 % (variando de 0.2 % a 14 %).
English version:
Coronaviruses are pathogens that cause infections of the respiratory tract, they are transmitted between humans and animals. They cause about 1/3 of upper respiratory infections in epidemics. They may also be involved in respiratory failure.
They are RNA viruses and look like a crown when viewed under electron microscopy, hence the name - Corona (crown). The coronavirus has been associated with the following forms of the disease:
1- Human coronaviruses (HCoV) - cause infections in humans, are ubiquitous and circulate seasonally in temperate climates, although they can be transmitted throughout the year. They usually cause self-limited manifestations of the common cold type.
2-SARS CoV - cause of the disease identified in February 2003 in Guangdong province in China and which manifests itself clinically as a rapidly progressive respiratory infection for respiratory failure, the term has been coined for causing Severe Acute Respiratory Syndrome. 8096 cases were identified with 774 deaths and a fatality rate of 9.6%. SARS transmission was considered to be controlled.
3-MERS-CoV - it is also a case of acute respiratory infection that quickly progresses to respiratory failure and renal failure. It was first identified in Saudi Arabia (hence the name Middle East Respiratory Syndrome) in 2012 and has already caused about 2400 laboratory-confirmed cases (half of which has been detected in health professionals), and there may be more cases. This disease was probably caused by dromedaries; interhuman transmission was confirmed. This infection is still under surveillance and the fatality-rate has reached 40%.
4-SARS CoV-2 (COVID-19) - the first cases were detected in December 2019 in the city of Wuhan, a city in the Hubei Province of China. Since then, more than 120,000 cases have been reported worldwide. These figures led the WHO to declare an international public health emergency in February 2020 and a pandemic in March. It is a respiratory infection that can progress to severe respiratory failure in elderly patients (over 60 years old) or with comorbidities. The disease is asymptomatic or mild in about 90% of cases. Ventilatory support is required by 10% and mechanical ventilation by 1%. Currently, the estimated average lethality is around 2 to 4% (ranging from 0.2% to 14%).
Médico infeciologista. Mestre e Doutor em Medicina Tropical. Autor do Livro Lições de Epidemiologia
Mostrar mensagens com a etiqueta Infectologia. Mostrar todas as mensagens
Mostrar mensagens com a etiqueta Infectologia. Mostrar todas as mensagens
sábado, março 14, 2020
terça-feira, agosto 13, 2019
Sarampo - como agir?
O sarampo é uma das infecções virais humanas que apresenta maior contagiosidade (capacidade de ser transmitida). Duas doses da vacina são suficientes para conferir imunidade. O cuidado do viajante deve ser redobrado, pois vários países com fluxo intenso de turistas estão a apresentar surtos de sarampo.
Clinicamente há uma fase inicial, chamada de prodromica ou catarrral, que se incia 2 a 4 dias antes da fase exantemática. Caracteriza-se por quadro agudo de febre com manifestações respiratórias superiores (tosse, coriza) e conjuntivite. O exantema se surge de 2 a 4 dias após o inicio da febre, incialmente na cabeça e se distribuindo para tronco e extremidades. A fase exantemática dura de 3 a 5 dias, havendo recuperação completa em cerca de 7 dias. As manchas de Koplik, pequenas placas brancoazuladas em mucosa jugal da boca, são consideradas patognomônicas (exclusivas do sarampo).
O diagnóstico do sarampo é clínico e amparado por evidência laboratorial de resposta imunológica ao vírus (mais comum) ou isolamento viral nas vias aéras na fase incial da doença. Testes de biologia molecular também podem ser realizados. O sarampo pode ser confundindo com rubéola, dengue, zika, herpes virus 6, infecção pelo parvovírus B19 e outras infecções virais.
Não há tratamento específico para o sarampo e a ocorrência de complicações é frequentemente relatada. A otite média aguda em 7 a 9 % dos casos, pneumonia em 1 a 6 %, diarreia em 8 %, encefalite pós-infecciosa em 1/1000 casos, panencefalite subaguda esclerosante em 1/10.000 casos e morte em 1/1000 casos. Indivíduos imunossuprimidos podem apresentar complicações graves como encefalite e pneumonia de células gigantes (Pneumonia de Hecht). É digno de nota a maior ocorrência de complicações em crianças desnutridas com hipovitaminose A, sendo indicada a reposição desta vitamina nestes casos.
Abaixo, as recomendações de imunização:
PNV - 1 dose entre 12 e 15 m (preferencialmente MMR , evitar MMR-V), segunda dose entre os 4 e 6 m (MMR ou MMR-V)
Epidemia - 1 dose pode ser dada após os 6 m, 1a. dose a partir dos 12 m e 2a. dose após os 13 m (intervalo de 28 dias entre as doses).
HIV - 1a. dose aos 12 m , 2a. dose depois dos 13 m.
Idade escolar/adolescentes - Todos devem ter 2 doses documentadas
Adultos - 2 doses ou evidência de imunidade
OBS. Sempre consultar o Plano Nacional de Vacinação.
A disseminação de epidemias de sarampo tem dois componentes principais, o primeiro é a baixa cobertura vacinal e o segundo é a facilidade de locomoção que faz com que pessoas adquiram a doença e a levem para outros sítios. No caso dos viajantes é importante definir critérios aceitáveis de imunidade contra o sarampo para posterior orientação vacinal. Abaixo os critérios propostos pelo CDC:
Documento escrito -- crianças em idade pré-escolar -- 1 dose
crianças em idade escolar e adolescentes -- 2 doses
Adultos com baixo risco - 1 dose
Adultos com alto risco - 2 doses
Evidencia laboratorial Infecção passada -- IgG positivo
Confirmação de caso -- IgM positiva ou IgG seroconversão ou aumento dos títulos de IgG entre fase aguda e de convalesência ou PCR positivo.
Data de nascimento Nascimento anterior a 1957.
Clinicamente há uma fase inicial, chamada de prodromica ou catarrral, que se incia 2 a 4 dias antes da fase exantemática. Caracteriza-se por quadro agudo de febre com manifestações respiratórias superiores (tosse, coriza) e conjuntivite. O exantema se surge de 2 a 4 dias após o inicio da febre, incialmente na cabeça e se distribuindo para tronco e extremidades. A fase exantemática dura de 3 a 5 dias, havendo recuperação completa em cerca de 7 dias. As manchas de Koplik, pequenas placas brancoazuladas em mucosa jugal da boca, são consideradas patognomônicas (exclusivas do sarampo).
O diagnóstico do sarampo é clínico e amparado por evidência laboratorial de resposta imunológica ao vírus (mais comum) ou isolamento viral nas vias aéras na fase incial da doença. Testes de biologia molecular também podem ser realizados. O sarampo pode ser confundindo com rubéola, dengue, zika, herpes virus 6, infecção pelo parvovírus B19 e outras infecções virais.
Não há tratamento específico para o sarampo e a ocorrência de complicações é frequentemente relatada. A otite média aguda em 7 a 9 % dos casos, pneumonia em 1 a 6 %, diarreia em 8 %, encefalite pós-infecciosa em 1/1000 casos, panencefalite subaguda esclerosante em 1/10.000 casos e morte em 1/1000 casos. Indivíduos imunossuprimidos podem apresentar complicações graves como encefalite e pneumonia de células gigantes (Pneumonia de Hecht). É digno de nota a maior ocorrência de complicações em crianças desnutridas com hipovitaminose A, sendo indicada a reposição desta vitamina nestes casos.
Abaixo, as recomendações de imunização:
PNV - 1 dose entre 12 e 15 m (preferencialmente MMR , evitar MMR-V), segunda dose entre os 4 e 6 m (MMR ou MMR-V)
Epidemia - 1 dose pode ser dada após os 6 m, 1a. dose a partir dos 12 m e 2a. dose após os 13 m (intervalo de 28 dias entre as doses).
HIV - 1a. dose aos 12 m , 2a. dose depois dos 13 m.
Idade escolar/adolescentes - Todos devem ter 2 doses documentadas
Adultos - 2 doses ou evidência de imunidade
OBS. Sempre consultar o Plano Nacional de Vacinação.
A disseminação de epidemias de sarampo tem dois componentes principais, o primeiro é a baixa cobertura vacinal e o segundo é a facilidade de locomoção que faz com que pessoas adquiram a doença e a levem para outros sítios. No caso dos viajantes é importante definir critérios aceitáveis de imunidade contra o sarampo para posterior orientação vacinal. Abaixo os critérios propostos pelo CDC:
Documento escrito -- crianças em idade pré-escolar -- 1 dose
crianças em idade escolar e adolescentes -- 2 doses
Adultos com baixo risco - 1 dose
Adultos com alto risco - 2 doses
Evidencia laboratorial Infecção passada -- IgG positivo
Confirmação de caso -- IgM positiva ou IgG seroconversão ou aumento dos títulos de IgG entre fase aguda e de convalesência ou PCR positivo.
Data de nascimento Nascimento anterior a 1957.
terça-feira, abril 10, 2018
Transmissão vertical da Hepatite C - algumas considerações - Vertical transmission of Hepatitis C - some considerations
Hoje fui questionado por uma colega sobre a amementação e transmissão vertical do vírus da hepatite C, achei que se tratava de uma informação relevante para partilhar de forma mais geral. Inicialmente, é importante salientar que este texto não substituí o acompanhamento com o médico especialista, portanto, trata-se somente de esclarecimentos acerca de alguns pontos deste problema.
A principal estratégia é a prevenção, idealmente antes da gravidez (pré-concepcional ou pré-nupcial). A hepatite C apresenta, atualmente, excelentes esquemas de tratamento.
Vertical transmission of Hepatitis C - some considerations
Today I was asked by a colleague about the breastfeeding and vertical transmission of the hepatitis C virus, I thought it was relevant information to share more generally. Initially, it is important to point out that this text does not replace the follow-up with the specialist doctor, so it is only a matter of clarifying some points of this problem.
The main strategy is prevention, ideally before pregnancy (pre-conception or prenuptial). Currently, Hepatitis C has excellent treatment regimens.
- A transmissão vertical do vírus da hepatite C é considerada de risco leve a moderado, variando de 1 a 20 % (média 5 %).
- O curso natural da doença não se altera durante a gravidez, podendo inclusive haver melhoras de marcadores bioquímicos (ALT e AST).
- Trabalho de parto prematuro, alterações do crescimento intra uterino estão associados à hepatite C crônica.
- Não há evidências sobre qual é a melhor via de parto para prevenir a transmissão.
- O diagnóstico deve ser feito com a carga viral qualitativa, a partir dos 3 meses de vida, ou sorologia, a partir dos 18 meses.
- A amamentação não está contraindicada (avaliar co-infecção com o HIV), exceto se houver sangramentos ou fissuras na região do mamilo.
A principal estratégia é a prevenção, idealmente antes da gravidez (pré-concepcional ou pré-nupcial). A hepatite C apresenta, atualmente, excelentes esquemas de tratamento.
Vertical transmission of Hepatitis C - some considerations
Today I was asked by a colleague about the breastfeeding and vertical transmission of the hepatitis C virus, I thought it was relevant information to share more generally. Initially, it is important to point out that this text does not replace the follow-up with the specialist doctor, so it is only a matter of clarifying some points of this problem.
- Vertical transmission of hepatitis C virus is considered mild to moderate risk, ranging from 1 to 20% (mean 5%).
- The natural course of the disease does not change during pregnancy, and there may even be improvements in biochemical markers (ALT and AST).
- Preterm labor, changes in intrauterine growth are associated with chronic hepatitis C.
- There is no evidence as to the best way of delivery to prevent transmission.
- The diagnosis should be made with the qualitative viral load, from 3 months of life, or serology, from 18 months.
- Breastfeeding is not contraindicated (assessing co-infection with HIV), unless there are bleeding or fissures in the nipple region.
The main strategy is prevention, ideally before pregnancy (pre-conception or prenuptial). Currently, Hepatitis C has excellent treatment regimens.
sábado, janeiro 13, 2018
Dose Fracionada da Vacina contra a Febre Amarela, há evidências? - Fractional Dose of the Yellow Fever Vaccine, is there evidence?
A Febre Amarela é considerada como a febre hemorrágica original, sendo um problema de saúde pública há mais de dois séculos (link). Uma vacina eficaz existe desde a década de 30 e é a única exigida internacionalmente como recomendação do regulamento sanitário internacional. Apesar de sua alta eficácia, ainda há surgimentos de surtos no mundo aquando também se associam graves problemas de abastecimento. Em 2016, no surto de FA em Angola e na República Democrática do Congo, houve sério risco de desabastecimento dos estoques internacionais. A OMS, baseado em dois estudos brasileiros que avaliaram positivamente a admisnistração de até 1/9 da dose plena da vacina 17DD fabricada no Brasil , sugeriu o fracionamento em 1/5 da dose em situações de risco de desabastecimento. Essa decisão permitiu que 2 milhões de doses da vacina imunizassem 10 milhões de pessoas em África.
Portanto, só há dois estudos, realizados há cerca de 10 anos, que validam o fracionamento da dose da vacina fabricada no Brasil. Esse uso nunca passou por autorização de uma agência reguladora e é considerado "off-label". Neste contexto, o fracionamento só deve ser aconselhado em situações de emergência em que há, de facto, um surto em andamento e em que a capacidade dos estoques não permitam a imunização com a dose plena. Esta deve ser oferecida à crianças menores de dois anos, lembrando que a vacina não é recomendada para maiores de 9 meses e menores de 60 anos (para outras restrições, consultar o manual do Ministério da Saúde).
Não houve tempo para se avaliar o impacto da vacinação em Angola e na RDC, sabe-se que o surto da doença foi considerado terminado em 23 de dezembro de 2016 no primeiro país e, em 14 de fevereiro de 2017, no último.
Em conclusão, não há aprovação formal para o uso da dose fracionada, mas em casos de emergência de saúde pública, justifica-se a sua prática pelas autoridades sanitárias. Mais estudos sobre a edicácia da vacina em dose fracionada têm que ser realizados com o objetivo desta forma de uso seja aprovada pelas agências de regulação.
English:
Yellow Fever is considered as the original hemorrhagic fever, being a public health problem for more than two centuries (link). An effective vaccine has existed since the 1930s and is the only internationally required as a recommendation in the international health regulations. Despite its high efficiency, there are still outbreaks in the world when serious supply problems are also associated. In 2016, in the outbreak of FA in Angola and in the Democratic Republic of Congo, there was a serious risk of a shortage of international stocks. The WHO, based on two Brazilian studies that positively evaluated the admission of up to 1/9 of the full dose of the 17DD vaccine manufactured in Brazil, suggested the fractionation in 1/5 of the dose in situations of risk of shortages. This decision allowed 2 million doses of the vaccine to immunize 10 million people in Africa.
Therefore, there are only two studies, carried out about 10 years ago, that validate the dose fractionation of the vaccine manufactured in Brazil. Such use has never been authorized by a regulatory agency and is considered off-label. Considering this situation, fractionation should only be advised in emergency situations where there is, in fact, an outbreak in progress and where the capacity of the stocks does not allow immunization with the full dose. The full dose should be offered to children less than two years old, remembering that the vaccine is recommended for children over 9 months and under 60 years of age (for other restrictions, see the Ministry of Health manual).
There was no time to evaluate the impact of vaccination in Angola and DRC, it is known that the outbreak of the disease was considered finished on December 23, 2016 in the first country and, on February 14, 2017, in the latter.
In conclusion, there is no formal approval for the use of the fractionated dose, but in cases of public health emergency, its practice is justified by the sanitary authorities. Further studies on the fractional dose vaccine dosage have to be performed for the purpose of regulatory approval.
Portanto, só há dois estudos, realizados há cerca de 10 anos, que validam o fracionamento da dose da vacina fabricada no Brasil. Esse uso nunca passou por autorização de uma agência reguladora e é considerado "off-label". Neste contexto, o fracionamento só deve ser aconselhado em situações de emergência em que há, de facto, um surto em andamento e em que a capacidade dos estoques não permitam a imunização com a dose plena. Esta deve ser oferecida à crianças menores de dois anos, lembrando que a vacina não é recomendada para maiores de 9 meses e menores de 60 anos (para outras restrições, consultar o manual do Ministério da Saúde).
Não houve tempo para se avaliar o impacto da vacinação em Angola e na RDC, sabe-se que o surto da doença foi considerado terminado em 23 de dezembro de 2016 no primeiro país e, em 14 de fevereiro de 2017, no último.
Em conclusão, não há aprovação formal para o uso da dose fracionada, mas em casos de emergência de saúde pública, justifica-se a sua prática pelas autoridades sanitárias. Mais estudos sobre a edicácia da vacina em dose fracionada têm que ser realizados com o objetivo desta forma de uso seja aprovada pelas agências de regulação.
English:
Yellow Fever is considered as the original hemorrhagic fever, being a public health problem for more than two centuries (link). An effective vaccine has existed since the 1930s and is the only internationally required as a recommendation in the international health regulations. Despite its high efficiency, there are still outbreaks in the world when serious supply problems are also associated. In 2016, in the outbreak of FA in Angola and in the Democratic Republic of Congo, there was a serious risk of a shortage of international stocks. The WHO, based on two Brazilian studies that positively evaluated the admission of up to 1/9 of the full dose of the 17DD vaccine manufactured in Brazil, suggested the fractionation in 1/5 of the dose in situations of risk of shortages. This decision allowed 2 million doses of the vaccine to immunize 10 million people in Africa.
Therefore, there are only two studies, carried out about 10 years ago, that validate the dose fractionation of the vaccine manufactured in Brazil. Such use has never been authorized by a regulatory agency and is considered off-label. Considering this situation, fractionation should only be advised in emergency situations where there is, in fact, an outbreak in progress and where the capacity of the stocks does not allow immunization with the full dose. The full dose should be offered to children less than two years old, remembering that the vaccine is recommended for children over 9 months and under 60 years of age (for other restrictions, see the Ministry of Health manual).
There was no time to evaluate the impact of vaccination in Angola and DRC, it is known that the outbreak of the disease was considered finished on December 23, 2016 in the first country and, on February 14, 2017, in the latter.
In conclusion, there is no formal approval for the use of the fractionated dose, but in cases of public health emergency, its practice is justified by the sanitary authorities. Further studies on the fractional dose vaccine dosage have to be performed for the purpose of regulatory approval.
terça-feira, setembro 19, 2017
Meropenem+Varbobactam novo antimicrobiano aprovado para uso pelo FDA - Meropenem + Varbobactam new antimicrobial approved for use by the FDA.
Foi aprovado no fim de agosto mais uma combinação de antimicrobiano com inbidor de betalactamase, o Meropenem/Varbobactam (Vabomere). O seu uso foi liberado para adultos ( mariores que 18 anos) e com diganóstico de infecção do trato urinário complicadas (pielonefrite) causada por bactérias sensíveis.
A dose recomendada de Meropenem/Varbobactam é de 4 g (2g de meropenem + 2g varbobactam) de 8/8 h por 14 dias em doentes com função renal normal. A apresentação é em pó para reconstituição contendo 1g/1g total 2g. Doentes com disfunção renal devem ter a dose ajustada de acordo com a TFG.
Em ensaios clínicos, o Meropenem/Varbobactam mostrou-se seguro para uso clínico, apresentando mais frequentemente como cefeitos colaterais: cefaleia (8,8 %), reação no local de infusão (4,4%), diarreia (3,3%), aumento de transaminases (1,8%), hipocalemia (1,1 %). Possui interações medicamentosas com o valproato e probenecide. Não foi aprovado para uso em gestantes (possível efeito teratogênico) nem em crianças. Mais estudos e farmacovigilância são necessários.
O antimicrobiano mostrou efeito contra enterobactérias em presença de algumas betalactamases e ESBL. Não foi ativa contra bactérias que produzem metalobetalactamase e oxacilinases com ação de carbapenemase. O uso vai depender do perfil antimicrobiano da instituição. A associação com varbobactam recuperou a atividade do meropenem em bactérias resistentes.
Em primeira análise, este antimicrobiano ainda necessita de mais estudos e foi apro vado para uma única indicação. Ainda é cedo para avaliarmos a sua utilidade em bactérias MDR.
English version:
Another antimicrobial combination with beta-lactamase inhibitor, Meropenem / Varbobactam (Vabomere), was approved at the end of August. Its use has been released to adults (over the age of 18) and to the diagnosis of complicated urinary tract infection (pyelonephritis) caused by sensitive bacteria.
The recommended dose of Meropenem / Varbobactam is 4 g (2 g meropenem + 2 g varbobactam) 8/8 h for 14 days in patients with normal renal function. The presentation is powder for reconstitution containing 1g / 1g total 2g. Patients with renal impairment should have the dose adjusted according to GFR.
In clinical trials, Meropenem / Varbobactam was shown to be safe for clinical use, with headache (8.8%), infusion reaction (4.4%), diarrhea (3.3%), increased transaminases (1.8%), hypokalemia (1.1%). It has drug interactions with valproate and probenecid. It has not been approved for use in pregnant women (possible teratogenic effect) or in children. Further studies and pharmacovigilance are required.
The antimicrobial showed an effect against enterobacteria in the presence of some beta-lactamases and ESBL. It was not active against bacteria that produce metalobetalactamase and oxacillinases with the action of carbapenemase. The use will depend on the antimicrobial profile of the institution. The association with varbobactam recovered the activity of meropenem in resistant bacteria.
In the first analysis, this antimicrobial still needs more studies and was approved for a single indication. It is too early to assess its usefulness in MDR bacteria.
A dose recomendada de Meropenem/Varbobactam é de 4 g (2g de meropenem + 2g varbobactam) de 8/8 h por 14 dias em doentes com função renal normal. A apresentação é em pó para reconstituição contendo 1g/1g total 2g. Doentes com disfunção renal devem ter a dose ajustada de acordo com a TFG.
Em ensaios clínicos, o Meropenem/Varbobactam mostrou-se seguro para uso clínico, apresentando mais frequentemente como cefeitos colaterais: cefaleia (8,8 %), reação no local de infusão (4,4%), diarreia (3,3%), aumento de transaminases (1,8%), hipocalemia (1,1 %). Possui interações medicamentosas com o valproato e probenecide. Não foi aprovado para uso em gestantes (possível efeito teratogênico) nem em crianças. Mais estudos e farmacovigilância são necessários.
O antimicrobiano mostrou efeito contra enterobactérias em presença de algumas betalactamases e ESBL. Não foi ativa contra bactérias que produzem metalobetalactamase e oxacilinases com ação de carbapenemase. O uso vai depender do perfil antimicrobiano da instituição. A associação com varbobactam recuperou a atividade do meropenem em bactérias resistentes.
Em primeira análise, este antimicrobiano ainda necessita de mais estudos e foi apro vado para uma única indicação. Ainda é cedo para avaliarmos a sua utilidade em bactérias MDR.
English version:
Another antimicrobial combination with beta-lactamase inhibitor, Meropenem / Varbobactam (Vabomere), was approved at the end of August. Its use has been released to adults (over the age of 18) and to the diagnosis of complicated urinary tract infection (pyelonephritis) caused by sensitive bacteria.
The recommended dose of Meropenem / Varbobactam is 4 g (2 g meropenem + 2 g varbobactam) 8/8 h for 14 days in patients with normal renal function. The presentation is powder for reconstitution containing 1g / 1g total 2g. Patients with renal impairment should have the dose adjusted according to GFR.
In clinical trials, Meropenem / Varbobactam was shown to be safe for clinical use, with headache (8.8%), infusion reaction (4.4%), diarrhea (3.3%), increased transaminases (1.8%), hypokalemia (1.1%). It has drug interactions with valproate and probenecid. It has not been approved for use in pregnant women (possible teratogenic effect) or in children. Further studies and pharmacovigilance are required.
The antimicrobial showed an effect against enterobacteria in the presence of some beta-lactamases and ESBL. It was not active against bacteria that produce metalobetalactamase and oxacillinases with the action of carbapenemase. The use will depend on the antimicrobial profile of the institution. The association with varbobactam recovered the activity of meropenem in resistant bacteria.
In the first analysis, this antimicrobial still needs more studies and was approved for a single indication. It is too early to assess its usefulness in MDR bacteria.
quarta-feira, março 15, 2017
Plasmódio de símios infecta humanos no Rio de Janeiro
O Rio de Janeiro, o estado, não se encontra em área endêmica para malária, apesar de já ter tido no passado participação na epidemiologia da doença no Brasil, até o ano de 1968. No entanto, a partir de 1993, casos esporádicos de transmissão autóctone têm sido detectados no estado, sendo o P. vivax considerado como agente etiológico. De 2006 a 2014 foram 61 casos diagnosticados.
A grande novidade foi que em um estudo molecular realizado em cepas isoladas de pacientes que frequentaram uma região de Mata Atlântica em Nova Friburgo (Lumiar), Macaé e Petrópolis permitiu a identificação de uma espécie de plasmódio antes considerada exclusiva de macacos, o P. simium. Macacos da região também apresentavam o parasito sanguíneo. Abaixo, um mapa elaborado pelo jornal o Globo:
A grande novidade foi que em um estudo molecular realizado em cepas isoladas de pacientes que frequentaram uma região de Mata Atlântica em Nova Friburgo (Lumiar), Macaé e Petrópolis permitiu a identificação de uma espécie de plasmódio antes considerada exclusiva de macacos, o P. simium. Macacos da região também apresentavam o parasito sanguíneo. Abaixo, um mapa elaborado pelo jornal o Globo:
X - Doença em Humanos e Macacos Infectados. A área verde representa a Mata Atlântica (fonte: O Globo).
Basicamente, são 4 as espécies de plasmódio exclusivas de seres humanos: o vivax, malarie, falciparum e o ovale. Recentemente, uma espécie que causava doença em macacos foi implicada também na doença em seres humanos, o P. knowlesi (já escrevi sobre esta espécie aqui).
O P. knowlesi causava casos esporádicos em seres humanos na década de 50/60 em países do sudeste asiático, no entanto, mais recentemente, está implicado em mais de 60 % dos casos naquela região. O Rio não é uma região de transmissão intensa de malária, mas uma espécie autóctone e que tenha o potencial de ser transmitida entre os humanos (no momento parece que a transmissão se dá de macaco para o humano) pode ser preocupante. Esse fenômeno ainda não foi comprovado, mas vamos esperar por novos estudos para sabermos de facto como se dá a cadeia de transmissão deste parasito naquela bela região.
Um pouco sobre a Febre Amarela - História (I) - A Little About Yellow Fever - History (I)
A Febre Amarela(FA) é uma doença febril aguda e hemorrágica transmitida por artrópode, seu principal vetor urbano são os mosquitos do gênero Aedes e os vetores silvestres os mosquitos do gênero Haemagogus e Sabethes. A doença é endêmica em partes da América do Sul e da África Sub-Saariana, de onde é considerada originária, de acordo com estudos filogenéticos.
A Febre Amarela foi levada para as Américas por meio do tráfico de escravos, que perdurou do século XVI até o século XIX. Acredita-se que mais de 12.5 milhões de escravos tenham sido transportados em cerca de 35000 viagens transatlânticas em navios negreiros, que tinham a capacidade de transportar de 300 a 600 escravos por viagem. Além dos escravos, os navios trouxeram também o vírus da FA e o seu vetor, que rapidamente adaptou-se às condições ambientais do Novo Mundo.
No Brasil, a Febre Amarela torna-se um problema sanitário a partir de meados do século XIX, apesar de haver evidências de sua presença muito antes disso. Há relatos de uma epidemia em Salvador que se acreditou se dever a um navio negreiro oriundo de Nova Orleans, no inicio de 1849, causando cerca de 90 mil casos e 4 mil mortes (total de 260 mil habitantes). Em dezembro de 1849, o navio atracou na capital do Império, o Rio de Janeiro. Em 1850, houve uma terrível epidemia que acometeu principalmente a população mestiça e branca da cidade, poupando os de origem africana. Nos anos seguintes, o Rio de Janeiro foi acometido por epidemias de FA até 1860, quando, num período de 10 anos, foi observada uma pausa até o recrudescimento em 1870.
Várias teorias foram geradas para explicar a ocorrência de FA, os religiosos apelavam para um castigo divino, que se deu pelo fato dos habitantes da capital se dedicarem às orgias e aos bailes. No entanto, as maiores discussões se deram no campo da medicina. A grande dúvida era de como se transmitia a FA e como ela se estabeleceu na cidade. Esta discussão se dicotomizou entre dois grupos, de um lado os médicos que acreditavam que o contágio era a principal forma de transmissão, os contagionistas, e os infeccionistas que acreditavam se tratar de uma doença originada dos miasmas infectantes da cidade. Nesta altura, o Rio de Janeiro era uma cidade precariamente provida de sistemas de saneamento, tendo os habitantes de coabitar com lixo e esgoto a céu aberto. Os maus ares que surgiam da putrefação da matéria orgânica seriam os responsáveis pela ocorrência da doença, sendo, portanto, muito pior para os estrangeiros que não estavam "aclimatados" à estas condições. A vertente dos infeccionistas acreditava que a FA surgiu e se estabeleceu pelas condições existentes nas próprias cidades brasileiras, enquanto os contagionistas acreditavam que a doença houvera sido importada da África em decorrência do comércio humano. De qualquer forma, foi criada a Junta de Higiene que ficou responsável pelas medidas de controle da doença, sendo aplicadas as que eram conhecidas até então, como a quarentena e o isolamento de indivíduos.
Em 1895, Carlos Finlay, pesquisador cubano, descobriu que a doença era transmitida por meio de um vetor, o mosquito Stegomyia fasciata (Aedes aegypti). A partir deste conhecimento, Oswaldo Cruz inicia uma campanha para erradicação do vetor na capital federal e, em 1904, acaba com a FA nesta localidade. Em 1944, foi diagnosticado o último caso urbano da doença em Sena Madureira, no Acre, e na, década de 70, o Aedes aegypti foi considerado erradicado do território brasileiro.
Text in English:
Yellow Fever (AF) is an acute and hemorrhagic febrile disease transmitted by an arthropod, its main urban vector is mosquitoes of the genus Aedes and the wild vectors are the mosquitoes of the genus Haemagogus and Sabethes. The disease is endemic in parts of South America and Sub-Saharan Africa, where it is considered to be of origin, according to phylogenetic studies.
The Yellow Fever was carried to the Americas through the slave trade, which lasted from the 16th century until the 19th century. It is believed that more than 12.5 million slaves were transported on about 35,000 transatlantic voyages on slave ships, which had the capacity to carry 300 to 600 slaves per trip. In addition to the slaves, the ships also brought the FA virus and its vector, which quickly adapted to the New World environmental conditions.
In Brazil, Yellow Fever has become a health problem since the mid-nineteenth century, although there is evidence of its presence long before that. There are reports of an epidemic in Salvador that was believed to be due to a slave ship from New Orleans at the beginning of 1849, causing about 90,000 cases and 4,000 deaths (a total of 260,000 inhabitants). In December 1849, the ship docked in the capital of the Empire, Rio de Janeiro. In 1850, there was a terrible epidemic that affected mainly the white and mestizo population of the city, sparing those of African origin. In the following years, Rio de Janeiro was affected by FMD epidemics until 1860, when a period of 10 years was observed until the resurgence in 1870.
Several theories were generated to explain the occurrence of FA, the religious appealed to a divine punishment, which was given by the inhabitants of the capital engaged in orgies and dances. However, the largest discussions have taken place in the medical field. The big question was how the FA was transmitted and how it settled in the city. This discussion was dichotomized between two groups, on the one hand, the doctors who believed that contagion was the main form of transmission, the contagionists, and the "infectionists" who believed it to be a disease originated from the infectious miasms of the city. At that time, Rio de Janeiro was a city precariously provided with sanitation systems, with the inhabitants living with open garbage and sewage. The bad airs that arose from the organic matter putrefaction would be responsible for the occurrence of the disease, and, therefore, much worse for the foreigners who were not "acclimated" to these conditions. The infectious side believed that the FA emerged and was established by the conditions existing in the Brazilian cities themselves, while the contagionists believed that the disease had been imported from Africa as a result of human trade. In any case, the Board of Hygiene was created, which was responsible for the control measures of the disease, applying what was known until then, such as quarantine and isolation of individuals.
In 1895, Carlos Finlay, a Cuban researcher, discovered that the disease was transmitted through a vector, the mosquito Stegomyia fasciata (Aedes aegypti). From this knowledge, Oswaldo Cruz initiates a campaign to eradicate the vector in the federal capital and, in 1904, ends the FA in this locality. In 1944, the last urban case of the disease was diagnosed in Sena Madureira, Acre, and in the 1970s Aedes aegypti was considered eradicated from Brazilian territory.
A Febre Amarela foi levada para as Américas por meio do tráfico de escravos, que perdurou do século XVI até o século XIX. Acredita-se que mais de 12.5 milhões de escravos tenham sido transportados em cerca de 35000 viagens transatlânticas em navios negreiros, que tinham a capacidade de transportar de 300 a 600 escravos por viagem. Além dos escravos, os navios trouxeram também o vírus da FA e o seu vetor, que rapidamente adaptou-se às condições ambientais do Novo Mundo.
No Brasil, a Febre Amarela torna-se um problema sanitário a partir de meados do século XIX, apesar de haver evidências de sua presença muito antes disso. Há relatos de uma epidemia em Salvador que se acreditou se dever a um navio negreiro oriundo de Nova Orleans, no inicio de 1849, causando cerca de 90 mil casos e 4 mil mortes (total de 260 mil habitantes). Em dezembro de 1849, o navio atracou na capital do Império, o Rio de Janeiro. Em 1850, houve uma terrível epidemia que acometeu principalmente a população mestiça e branca da cidade, poupando os de origem africana. Nos anos seguintes, o Rio de Janeiro foi acometido por epidemias de FA até 1860, quando, num período de 10 anos, foi observada uma pausa até o recrudescimento em 1870.
Várias teorias foram geradas para explicar a ocorrência de FA, os religiosos apelavam para um castigo divino, que se deu pelo fato dos habitantes da capital se dedicarem às orgias e aos bailes. No entanto, as maiores discussões se deram no campo da medicina. A grande dúvida era de como se transmitia a FA e como ela se estabeleceu na cidade. Esta discussão se dicotomizou entre dois grupos, de um lado os médicos que acreditavam que o contágio era a principal forma de transmissão, os contagionistas, e os infeccionistas que acreditavam se tratar de uma doença originada dos miasmas infectantes da cidade. Nesta altura, o Rio de Janeiro era uma cidade precariamente provida de sistemas de saneamento, tendo os habitantes de coabitar com lixo e esgoto a céu aberto. Os maus ares que surgiam da putrefação da matéria orgânica seriam os responsáveis pela ocorrência da doença, sendo, portanto, muito pior para os estrangeiros que não estavam "aclimatados" à estas condições. A vertente dos infeccionistas acreditava que a FA surgiu e se estabeleceu pelas condições existentes nas próprias cidades brasileiras, enquanto os contagionistas acreditavam que a doença houvera sido importada da África em decorrência do comércio humano. De qualquer forma, foi criada a Junta de Higiene que ficou responsável pelas medidas de controle da doença, sendo aplicadas as que eram conhecidas até então, como a quarentena e o isolamento de indivíduos.
Em 1895, Carlos Finlay, pesquisador cubano, descobriu que a doença era transmitida por meio de um vetor, o mosquito Stegomyia fasciata (Aedes aegypti). A partir deste conhecimento, Oswaldo Cruz inicia uma campanha para erradicação do vetor na capital federal e, em 1904, acaba com a FA nesta localidade. Em 1944, foi diagnosticado o último caso urbano da doença em Sena Madureira, no Acre, e na, década de 70, o Aedes aegypti foi considerado erradicado do território brasileiro.
Text in English:
Yellow Fever (AF) is an acute and hemorrhagic febrile disease transmitted by an arthropod, its main urban vector is mosquitoes of the genus Aedes and the wild vectors are the mosquitoes of the genus Haemagogus and Sabethes. The disease is endemic in parts of South America and Sub-Saharan Africa, where it is considered to be of origin, according to phylogenetic studies.
The Yellow Fever was carried to the Americas through the slave trade, which lasted from the 16th century until the 19th century. It is believed that more than 12.5 million slaves were transported on about 35,000 transatlantic voyages on slave ships, which had the capacity to carry 300 to 600 slaves per trip. In addition to the slaves, the ships also brought the FA virus and its vector, which quickly adapted to the New World environmental conditions.
In Brazil, Yellow Fever has become a health problem since the mid-nineteenth century, although there is evidence of its presence long before that. There are reports of an epidemic in Salvador that was believed to be due to a slave ship from New Orleans at the beginning of 1849, causing about 90,000 cases and 4,000 deaths (a total of 260,000 inhabitants). In December 1849, the ship docked in the capital of the Empire, Rio de Janeiro. In 1850, there was a terrible epidemic that affected mainly the white and mestizo population of the city, sparing those of African origin. In the following years, Rio de Janeiro was affected by FMD epidemics until 1860, when a period of 10 years was observed until the resurgence in 1870.
Several theories were generated to explain the occurrence of FA, the religious appealed to a divine punishment, which was given by the inhabitants of the capital engaged in orgies and dances. However, the largest discussions have taken place in the medical field. The big question was how the FA was transmitted and how it settled in the city. This discussion was dichotomized between two groups, on the one hand, the doctors who believed that contagion was the main form of transmission, the contagionists, and the "infectionists" who believed it to be a disease originated from the infectious miasms of the city. At that time, Rio de Janeiro was a city precariously provided with sanitation systems, with the inhabitants living with open garbage and sewage. The bad airs that arose from the organic matter putrefaction would be responsible for the occurrence of the disease, and, therefore, much worse for the foreigners who were not "acclimated" to these conditions. The infectious side believed that the FA emerged and was established by the conditions existing in the Brazilian cities themselves, while the contagionists believed that the disease had been imported from Africa as a result of human trade. In any case, the Board of Hygiene was created, which was responsible for the control measures of the disease, applying what was known until then, such as quarantine and isolation of individuals.
In 1895, Carlos Finlay, a Cuban researcher, discovered that the disease was transmitted through a vector, the mosquito Stegomyia fasciata (Aedes aegypti). From this knowledge, Oswaldo Cruz initiates a campaign to eradicate the vector in the federal capital and, in 1904, ends the FA in this locality. In 1944, the last urban case of the disease was diagnosed in Sena Madureira, Acre, and in the 1970s Aedes aegypti was considered eradicated from Brazilian territory.
sábado, maio 14, 2016
Transmissão transfusional do Zika
Zika vírus é um flavivírus descoberto pela primeira vez em 1947. O risco de transmissão transfusional por outros vírus da mesma família é conhecido, principalmente para o dengue e West Nile virus. A transmissão transfusional pelo Zika foi documentada pela primeira vez no Brasil em 2015. Em áreas com transmissão do vírus deve-se estabelecer estratégias no sistema de sangue e hemoderivados de forma a manter os estoques disponíveis para as necessidades dos serviços de saúde.
Medidas recomendadas para se evitar a transmissão transfusional:
1)Em zonas não endêmicas deve-se recomendar que se evite a doação de sangue por período de 14 dias após retorno de área de transmissão e após 28 dias após resolução dos sintomas em pessoas com doenças documentada (mesmo para dengue). No caso de indivíduos que tiveram Zika é também recomendada a aplicação de medidas de inativação viral no sangue doado.
2)Implementação de testagem dos doadores com testes de biologia molecular, esta estratégia encarece o processamento dos hemoderivados e também necessita de equipamentos e técnicos para sua realização, no entanto mostrou-se eficaz durante a epidemia na Polinésia Francesa.
3)Inativação do vírus nos hemoderivados por meio de tratamento com Amatosalen e iluminação com raios UV. Esta estratégia mostrou-se eficaz contra o ZIKV e também contra outros arbovírus.
4)Gestantes só devem receber hemoderivados comprovadamente negativos para ZIKV.
Urbanização da Hantavirose, problema emergente.
Figura - Fonte CDC
A aquisição de hantavirose está relacionada quase exclusivamente à atividade rural, nos períodos de colheita, quando os silos das fazendas se encontram abastecidos e atraem os roedores que se alimentam principalmente dos grãos estocados. O homem adquire a infecção pela inalação de excretas de roedores infectados e o ambiente fechado e privado de iluminação natural favorece a concentração dos aerossóis contaminados, aumentando a possibilidade de aquisição da doença pelo homem. A doença afeta principalmente adultos jovens do sexo masculino. No entanto cada vez mais se detectam casos ligados à transmissão em zonas rurais como recentemente na Província de Azul, na Argentina (Morte de Criança por Hantavirose na Argentina). No Distrito Federal do Brasil também há relatos de casos em áreas periurbanas. Abaixo uma pequena introdução à Hantavirose; adicionalmente sugiro este artigo de revisão para aprofundamento do conhecimento acerca da doença.
A hantavirose é uma doença zoonótica, transmitida ao homem por meio da inalação de excretas de roedores silvestres, amplamente distribuída no Mundo. Na atualidade é considerada doença emergente e constitui importante problema de saúde pública. Nas Américas, a manifestação clínica predominante da doença é Síndrome Pulmonar e Cardiovascular por Hantavírus (SPCVH) .
A doença ganhou reconhecimento
pela medicina ocidental, pela primeira vez, durante a Guerra da Coréia, no
início da década de 50, e se propagou, no ano de 1993, para diversos países da
América. Os primeiros casos da
doença nesse continente foram diagnosticados no ano de 1993, em um surto na
região de Four Corners, no sudoeste
dos Estados Unidos. Atualmente, a virose se encontra distribuída globalmente
atingindo a Europa, a Ásia e as três Américas, sendo que, na América do Sul, os
principais países atingidos são Brasil, Argentina, Chile e Paraguai .
Existem duas
formas clínicas distintas de hantavirose: a Febre Hemorrágica com Síndrome Renal
(FHSR), que ocorre na Ásia e na Europa e possui evolução benigna, e a SPCVH,
forma que ocorre nas Américas e possui alta letalidade. Ambas são doenças
sistêmicas febris que podem acometer diversos órgãos. Na FHSR, o rim é o
principal envolvido, enquanto que na SPCVH os principais órgãos afetados são os
pulmões e o coração .
O agente
causador da hantavirose é o Hantavírus,
um vírus esférico e envelopado de RNA de fita simples, pertencente à família Bunyaviridae. Quatro membros desse
gênero causam FHSR e cerca de duas dezenas causam SPCVH. Cada um deles infecta
roedores específicos e a sua nomenclatura deriva da região onde foi
identificado pela primeira vez .
O Hantavírus é transmitido ao homem por
roedores, principalmente silvestres, de diversos gêneros e espécies, que
abrigam o vírus sem, no entanto, apresentarem a doença. No continente americano
os principais reservatórios são os roedores silvestres da ordem Rodentia, família Muridae e subfamília Sigmodontinae.
Já nos continentes asiático e europeu, os principais roedores envolvidos pertencem
à subfamílias Murinae e Arvicolinae, particularmente aos gêneros
Apodemus e Clethrionomys .
Os
roedores eliminam os vírus na urina, nas fezes e na saliva e a transmissão
ocorre por inalação de aerossóis contendo partículas virais, formados por
ressecamento dessas secreções. Outras formas de transmissão mais raras são:
mordedura de roedores, ingestão de alimentos contaminados com secreções desses
animais e contato com excretas contendo o vírus com posterior introdução em
mucosas. Também foi evidenciada infecção por transmissão interpessoal no Chile
e na Argentina.
quarta-feira, maio 11, 2016
Febre de Oropouche - Oropouche fever
Figura - Regiões das Américas com relato de ocorrência de casos humanos de Febre de Oropouche (fonte: CAD. SAÚDE COLET., RIO DE JANEIRO, 15 (3): 303 - 318, 2007)
A Febre de Oropouche é uma doença viral transmitida por artrópodes. O vírus causador pertence à família Bunyaviridae e o seu transmissor é uma pequena mosca (3 mm) hematófaga Culicoides paraensis (maruim). São insetos encontrados em regiões ribeirinhas e alagadas com abundância de matéria orgânica. Outros vetores também mostraram-se capazes de transmitir a doença, como os mosquitos do gênero Culex e Aedes.
A doença foi descrita pela primeira vez no Pará e depois encontrada em outras regiões do estado do Amazonas. Recentemente um surto foi relatado em cidades do Peru (link: Oropouche em Cusco). No Brasil também já causou surtos no Maranhão (Porto Franco) e em Tocantins (Tocantinópolis) no fim da década de 80. Estudos recentes indicam que o Oropouche pode ser a responsável por mais da metade dos casos de doença febril aguda nas Regiões Amazônicas (principalmente Pará, Norte de Tocantis, Maranhão e Amazonas). Epidemias em vilarejos (zonas urbanas) são frequentes e chamam pouca a atenção das autoridades sanitárias nacionais.
A doença caracteriza-se por período de incubação de 3 a 5 dias com evolução para febre, mialgia, cefaleia, artralgia e fotofobia intensa. A duração dos sintomas costuma ser em média de 3 dias com evolução geralmente benigna, no entanto foram descritos casos com meningite asséptica. O quadro clínico se aproxima muito do observado na dengue, portanto a maior parte dos diagnósticos pode ser erroneamente atribuído à dengue.
O diagnóstico se realiza nomeadamente por meio de exames sorológicos e não há tratamento específico e nem vacinas disponíveis. A grande questão é a potencial capacidade de disseminação deste vírus para regiões mais populosas mais ao sul do Brasil, agregando complexidade ao diagnóstico diferencial e causando mais morbidade à população. A possibilidade de transmissão por mosquitos do gênero Culex e Aedes fortalece a necessidade de vigilância mais estreita aos casos de doença febril aguda em todos os estados brasileiros e países vizinhos.
English Version:
Oropouche
fever is a viral disease transmitted by arthropods. The causative virus belongs
to the family Bunyaviridae, and its
transmitter is a small fly (3 mm) hematophagous Culicoides paraensis (maruím).
They are insects found in Riverside
regions and flooded with an abundance of
organic matter. Other vectors were also able to transmit the disease, such as
the mosquitoes of the genus Culex and Aedes.
The disease
was first described in Brazil in Pará state and later found in other regions of
the state of Amazonas. Recently an outbreak has been reported in Peruvian
cities (link: Oropouche in Cusco). In Brazil, it has also caused outbreaks in
Maranhão (Porto Franco) and Tocantins (Tocantinópolis) in the late 1980s.
Recent studies indicate that Oropouche may be responsible for more than half of
the cases of acute febrile disease in the
Amazonian Regions Pará, North of Tocantins,
Maranhão, and Amazonas). Epidemics in
villages (urban areas) are frequent and draw little attention from national
health authorities.
The disease
is characterized by an incubation period
of 3 to 5 days with evolution to fever, myalgia, headache, arthralgia and
intense photophobia. The duration of the symptoms usually is in an average
of 3 days with generally benign evolution, nevertheless have been described
cases with aseptic meningitis. The
clinical picture is close to that observed in dengue, so most diagnoses can be erroneously
attributed to this virus.
The diagnosis
is made namely through serological tests,
and there is no specific treatment or vaccines available. The major issue is
the potential spread of this virus to more populated regions in southern
Brazil, adding complexity to the differential diagnosis and causing more
morbidity to the population. The possibility of transmission by mosquitoes of
the genus Culex and Aedes strengthens the need for closer surveillance to cases
of acute febrile illness in all Brazilian states and neighboring countries.
segunda-feira, dezembro 28, 2015
Vacina para Dengue é licenciada no Brasil.
Vacina para Dengue é licenciada no Brasil. A empresa Sanofi Pasteur conseguiu licença da vacina pela Anvisa e suas similares no México e na Filipina. Trata-se de uma vacina tetravalente que protege cerca de 60 % dos casos e 80-90 % das formas mais graves. Até o momento está autorizada para uso em pessoas de 9 a 45 anos.
Limitações até o momento:
1)Custo: a dose custa cerca de 20 euros, muito cara levando-se em conta a universalidade da dengue nos países acometidos (só no Bras...il cerca de 200 milhões) e a necessidade de revacinação semestralmente.
2)Idade: crianças menores que 9 anos não poderão neste momento se beneficiar, o que deixa desprevenido um grupo importante de suscetíveis.
3)Baixa eficiência: cerca de 60% nos ensaios.
4)É só para dengue, obviamente não resolve os outros graves problemas relacionados à Zika e ao CHIK.
Apesar destas limitações, já representa um grande avanço no combate à doença e à mortalidade associada.
Limitações até o momento:
1)Custo: a dose custa cerca de 20 euros, muito cara levando-se em conta a universalidade da dengue nos países acometidos (só no Bras...il cerca de 200 milhões) e a necessidade de revacinação semestralmente.
2)Idade: crianças menores que 9 anos não poderão neste momento se beneficiar, o que deixa desprevenido um grupo importante de suscetíveis.
3)Baixa eficiência: cerca de 60% nos ensaios.
4)É só para dengue, obviamente não resolve os outros graves problemas relacionados à Zika e ao CHIK.
Apesar destas limitações, já representa um grande avanço no combate à doença e à mortalidade associada.
quarta-feira, setembro 23, 2015
KPC: um desafio para o controle
Figura - Distribuição da KPC e suas variantes no Mundo (2013 - Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases, Price et al. Lancet)
A KPC (Klebsiella pneumoniae Carbapenemase) é uma beta lactamase capaz de hidrolisar a totalidade dos antibióticos beta lactâmicos, inclusive os carbapenemas e substâncias inibidoras da beta lactamase. O termo KPC gera confusão e é pouco preciso, já que esta enzima pode ser detectada em outras enterobactérias, como as do gênero Pseudomonas. Recentemente o CDC cunhou a denominação CPE ( Enterobactérias Produtoras de Carbapenemase), sendo, portanto, este termo mais preciso.
Surtos de infecção por K.pneumoniae KPC são descritos em diversos países e com padrão endêmico em alguns como os EUA e o Brasil. A proporção de bactérias KPCs isoladas em hospitais também vem crescendo, em 2011 era de 12 %, em 2012 65 % e em 2013 57 %. A letalidade também é maior em comparação com pacientes infectados por bactérias sensíveis, o excesso de letalidade chega a 20 %. A letalidade chega a 48 % dos pacientes diagnosticados com infecção da corrente circulatória.
Para o tratamento destas bactérias restam poucas opções, entre elas a colistina, gentamicina e tigeciclina. Usadas isoladamente ou em diferentes associações. Nenhuma destas opções é ideal. A colistina e a gentamicina são nefrotóxicas e sua combinação pode levar a quadros de insuficiência renal. A tigeciclina tem ação errática, portanto gera pouca confiança na sua utilização em pacientes graves. Para piorar já se detectam bactérias resistentes à colistina e o lançamento de novas drogas não acompanha a rapidez da geração de resistência. Recentemente foi lançado nos EUA a ceftazidima-avibactam, uma combinação que se mostra ativa contra a KPC, no entanto há relatos de rápida criação de resistência.
O controle ainda se dá pela identificação precoce da colonização (geralmente ocorre em até 4 8 h após a internação) e a separação dos pacientes detectados colonizados. Talvez seja este um dos maires problemas relacionados à assistência hospitalar, a falta de opções minimamente ideais e a gravidade dos casos torna um grande problema para médicos e gestores.
A KPC (Klebsiella pneumoniae Carbapenemase) é uma beta lactamase capaz de hidrolisar a totalidade dos antibióticos beta lactâmicos, inclusive os carbapenemas e substâncias inibidoras da beta lactamase. O termo KPC gera confusão e é pouco preciso, já que esta enzima pode ser detectada em outras enterobactérias, como as do gênero Pseudomonas. Recentemente o CDC cunhou a denominação CPE ( Enterobactérias Produtoras de Carbapenemase), sendo, portanto, este termo mais preciso.
Surtos de infecção por K.pneumoniae KPC são descritos em diversos países e com padrão endêmico em alguns como os EUA e o Brasil. A proporção de bactérias KPCs isoladas em hospitais também vem crescendo, em 2011 era de 12 %, em 2012 65 % e em 2013 57 %. A letalidade também é maior em comparação com pacientes infectados por bactérias sensíveis, o excesso de letalidade chega a 20 %. A letalidade chega a 48 % dos pacientes diagnosticados com infecção da corrente circulatória.
Para o tratamento destas bactérias restam poucas opções, entre elas a colistina, gentamicina e tigeciclina. Usadas isoladamente ou em diferentes associações. Nenhuma destas opções é ideal. A colistina e a gentamicina são nefrotóxicas e sua combinação pode levar a quadros de insuficiência renal. A tigeciclina tem ação errática, portanto gera pouca confiança na sua utilização em pacientes graves. Para piorar já se detectam bactérias resistentes à colistina e o lançamento de novas drogas não acompanha a rapidez da geração de resistência. Recentemente foi lançado nos EUA a ceftazidima-avibactam, uma combinação que se mostra ativa contra a KPC, no entanto há relatos de rápida criação de resistência.
O controle ainda se dá pela identificação precoce da colonização (geralmente ocorre em até 4 8 h após a internação) e a separação dos pacientes detectados colonizados. Talvez seja este um dos maires problemas relacionados à assistência hospitalar, a falta de opções minimamente ideais e a gravidade dos casos torna um grande problema para médicos e gestores.
quinta-feira, agosto 13, 2015
Chikungunya na Espanha
Figura - Localização de Gandia - Espanha.
No dia 03 de agosto deste ano foi detectado na cidade de Gandia na Espanha (próximo a Valencia) um caso de CHIK não associado à viagem a países endêmicos. A cidade de Gandia se localiza na costa mediterrânea da Espanha uma área em que há infestação de Aedes albopictus estabelecida (link) . Trata-se de um paciente de 60 anos que se encontrava anteriormente ao diagnóstico no sul da França ( Região de Languedoc-Roussillon, onde o mosquito também está presente). A sorologia foi positiva (IgM) e o paciente apresentava sintomas da doença.
Esse evento representa grave risco de disseminação da transmissão da doença nesta área, que apresenta as condições necessárias para o estabelecimento de epidemia dado que a Europa se encontra em pleno verão. Não há como prever o que vai acontecer, mas pode ser o estopim para uma situação epidemiológica preocupante.
Link para o alerta da OMS.
No dia 03 de agosto deste ano foi detectado na cidade de Gandia na Espanha (próximo a Valencia) um caso de CHIK não associado à viagem a países endêmicos. A cidade de Gandia se localiza na costa mediterrânea da Espanha uma área em que há infestação de Aedes albopictus estabelecida (link) . Trata-se de um paciente de 60 anos que se encontrava anteriormente ao diagnóstico no sul da França ( Região de Languedoc-Roussillon, onde o mosquito também está presente). A sorologia foi positiva (IgM) e o paciente apresentava sintomas da doença.
Esse evento representa grave risco de disseminação da transmissão da doença nesta área, que apresenta as condições necessárias para o estabelecimento de epidemia dado que a Europa se encontra em pleno verão. Não há como prever o que vai acontecer, mas pode ser o estopim para uma situação epidemiológica preocupante.
Link para o alerta da OMS.
sexta-feira, julho 31, 2015
Morcegos como reservatórios da Leishmaniose
Os posts tornaram-se mais escassos, pois estou extremamente concentrado em terminar alguns artigos sobre leishmaniose visceral, mas esse artigo eu achei interessante para comentar aqui no blog. A leishmaniose é uma doença causada por um protozoário que parasita os macrófagos dos mamíferos. Tem um ciclo complexo com reservatórios animais e vetores alados. Reservatórios silvestres como a raposa e marsupiais e doméstico como o cão são bem estabelecidos na dinâmica, todavia de vez em quando aparece uma nova evidência de que outros animais estariam envolvidos.
Nesse artigo de Oliveira e colaboradores que foi publicado essa semana na Acta Tropica é interessante, pois traz como evidência a observação que cerca de 17 % dos morcegos urbanos em uma cidade endêmica para leishmaniose se encontram infectados por L. infantum. Sabe-se também que os flebotomíneos podem também se alimentar do sangue desses animais. Essa descrição é muito intrigante e preocupante ao mesmo tempo. Mais um reservatório representa aumento da complexidade da execução de medidas de controle da doença e pode realmente inviabilizar a perspectiva de intervenção da saúde pública neste elo da cadeia. Também pode ajudar a explicar a mudança epidemiológica da doença nestas últimas décadas no Brasil, os morcegos são extremamente bem adaptados ao ambiente urbano e contam com uma grande população em praticamente todas as cidades.
Agora é aguardar outros estudos que se proponham a ligar os morcegos à transmissão da doença humana.
Link para o artigo: aqui
sábado, junho 27, 2015
Zika vírus no Brasil - qual situação atual?
Mapa do Promed com os casos de Zika no Brasil no último mês.
O ZIKV foi descoberto na década de 40 em uma floresta de Uganda, chamada Zika. O isolamento do vírus se deu de forma inesperada, pois estava-se fazendo pesquisas para a febre amarela com macacos sentinela presos nas copas das árvores. Desde então a doença disseminou-se pela África e pela Ásia. Em 2007 foi detectado um grande surto nas Ilhas do Oceano Pacífico. Neste ano isolou-se a doença no Brasil.
De acordo com fontes informais, só na Bahia já foram detectados mais de 20.000 casos suspeitos em mais de 160 municípios. Felizmente a doença é benigna, mas pode atrapalhar o diagnóstico com a dengue e tem sido associada ao aumento de casos de Síndrome de Guillain Barré. Outro problema também é na dificuldade de diagnóstico, ainda não há um kit comercial disponível.
Os casos que tenho notícia se caracterizam por febre baixa, prostração que evoluiu para exantema maculopapular em face que progride para o resto do corpo, inclusive palmas e solas. Duas características importantes é que o exantema é pruriginoso e a presença de conjuntivite intensa e sem pus.
domingo, junho 07, 2015
Breve Revisão acerca da doença por Zika Virus
Distribuição do Zika vírus .
O Zika Virus é um flavivírus relacionado à Febre Amarela e o Dengue e transmitido por vetores artrópodes (arbovirose). Foi isolado pela primeira vez na Uganda, na floresta de Zika em 1947. É endêmica no leste e oste da África já tendo sio detectado em surtos no Sudeste Asiático, Micronésia e Oceania. Foi reportado pela primeira vez nas Américas em 2014 na Ilha de Páscoa (território Chileno no Oceano Pacífico) provavelmente relacionado ao surto na Micronésia. Em 2015, casos foram confirmados na Região Sudeste e Nordeste do Brasil.O vírus é transmitido por mosquitos do gênero Aedes sp. Até o momento não foram descritos reservatórios animais do vírus. Clinicamente é caracterizada por febre de inicio agudo acompanhada de cefaleia discreta, no segundo dia da doença surge exantema maculopapular acometendo face, troncos, membros, palmas e solas. A febre cede um dia ou dois após o aparecimento do exantema, que persiste por mais alguns dias. São relatadas dores articulares discretas e dor lombar. Outras manifestações inespecíficas como anorexia, náuseas e vômitos podem ocorrer.É relatado também em alguns casos conjuntivite.
O diagnóstico diferencial se faz principalmente com dengue, chikungunya e outras doenças febris agudas como malária, leptospirose. Deve-se pensar também em doenças como artrite reativa e farmacodermia.
O diagnóstico pode ser realizado por meio de PCR até 11 dias de evolução da doença. Anticorpos IgM podem ser detectados a partir do terceiro dia de doença. Anticorpos IgG devem ser investigados no soro agudo e convalescente (sorologia pareada).
Não existe vacina e nem drogas antivirais específicas, o tratamento é sintomático com analgésicos e antitérmicos. Deve-se evitar o uso de aspirina (salicilatos), nomeadamente em territórios com circulação concomitante do vírus da dengue pela possibilidade de agravar o quadro em pacientes com essa doença. Até o momento não foi relatado nenhum óbito pela doença.
Medidas de Saúde Pública devem visar medidas contra o vetor, tanto coletivas quanto individuais. Nos locais em que o vírus ainda não esteja totalmente estabelecido, deve-se isolar os indivíduos infectados e evitar que eles tenham contacto com o vetor.
Ainda são desconhecidos vários aspectos da epidemiologia do Zika virus. Novos estudos com intuito de se investigar a dinâmica de transmissão da vírus poderão auxiliar na definição de fatores que possam contribuir para a formação de endemia nas regiões recentemente acometidas. Até lá, as medidas de controle vetorial devem ser intensificadas e muito cuidado deve-se ter em relação ao manejo do paciente, nomeadamente para se evitar o aumento dos casos de óbitos ocasionados pela dengue em decorrência de diagnósticos equivocados.
terça-feira, junho 02, 2015
MERS-CoV: doença emergente com alta letalidade
Figura - Países acometidos pelo MERS-CoV
A transmissão do vírus, um coronavírus, se dá por meio de gotículas respiratórias e contato íntimo com pessoas infectadas. A doença é considerada uma zoonose e a fonte são camelos (dromedário). Até o momento, todos os casos autóctones ocorreram em países da península arábica (listados acima). Casos importados já foram detectados em países da Europa e dos EUA.
O vírus tem predilecção por receptores DPP4 presentes abundantemente em células do pulmão (alvéolos e brônquios), alguns órgãos hematopoéticos, rins, intestino e fígado. O que explica a capacidade de disseminação do vírus pelo organismo.
O quadro clínico caracteriza-se por início de febre acompanhada de tosse, e dispneia após um período de incubação de 5 a 12 dias. A doença evolui para insuficiência respiratória e insuficiência múltipla de órgãos. Cerca de 3 a 4 em 10 indivíduos com o quadro grave falece, a maioria apresenta algum tipo de comorbidade. A doença também pode se manifestar com sintomas respiratórios leves.
Ainda não há vacinas e nem tratamento específico, portanto as medidas de detecção precoce de casos e de isolamento devem ser implementadas pelas vigilâncias de todos os países com especial atenção às pessoas oriundas das áreas com transmissão activa da doença.
Actualização:
Até Dezembro de 2019 foram notificados 2499 casos com 858 mortes. A boa notícia é que a vacina para esta infecção já foi desenvolvida e se mostrou promissora em ensaio clínico. Conclusão do estudo (link abaixo):
" The GLS-5300 MERS coronavirus vaccine was well tolerated with no vaccine-associated serious adverse events. Immune responses were dose-independent, detected in more than 85% of participants after two vaccinations, and durable through 1 year of follow-up. The data support further development of the GLS-5300 vaccine, including additional studies to test the efficacy of GLS-5300 in a region endemic for MERS coronavirus."
Ainda não há vacina disponível para o MERS-CoV no mercado e a doença continua em actividade, já tendo sido detectada em 27 países. A maiorida dos casos continua na Arábia Saudita.
Links úteis:
Link do CDC
Página do MERS-CoV na OMS
Ensaio clínico da vacina - Lancet
Plasmódio knowlesi é reponsável por 66% dos casos de Malária na Malásia
Figura - Macaca fascicularis ou macaco-cinomolgo, macaco do Sudeste Asiático associado com os casos da doença.
Em 1965 o primeiro caso de infeção por Plasmodium knowlesi foi detectado em um americano que a contraiu durante uma passagem por florestas da Malásia. Este parasito é encontrado naturalmente infectando primatas no sudeste asiático, a infecção humana adquirida naturalmente era considerada rara. Em 2004 um grande surto em seres humanos foi detectado em Sarawak, Bornéu Malasiano, desde então o P. knowlesi é considerado a quinta espécie de plasmódio parasita de homens. Atualmente, o governo da Malásia afirmou que dos 3923 casos detectados em 2014, 66 % foram causados pelo P. knowlesi, ou seja, a maioria dos casos.
Há mais de 150 espécies de parasitos causadores de malária, a maioria é espécie específico e somente quatro eram associados à casos humanos. O P. malarie é o parasito mais difícil de se encontrar causando doença em humanos, todavia vinha sendo frequentemente sendo detectado em pacientes da Malásia causando formas graves de malária. Por meio de técnicas de PCR, foi constatado que se tratava na realidade de P.knowlesi, indistinguível do malarie por meio de microscopia.
A principal preocupação é que o agente se adapte ao ser humano e que se espalhe por outras áreas endêmicas da doença, o que é mais preocupante é que está associada à formas graves de malária. |Ainda há muitas dúvidas, as teorias para esta adaptação envolvem à mudanças do comportamento do vetor (Anopheles leucosphyrus), que passou a preferir o repasto sanguíneo em seres humanos em decorrência do desflorestamento e mudança de habitat de macacos, anteriormente os alvos preferenciais dos mosquitos.
quinta-feira, maio 14, 2015
Diagnóstico do Chikungunya - Atualização
Vírus do CHIK isolado de humanos pela Fundação Oswaldo Cruz - Brasil.
Podemos perceber, pelo exposto, a importância do diagnóstico de CHIK e sua diferenciação de outras febres tropicais, nomeadamente a dengue. A disponibilidade dos kits de diagnóstico vem aumentando, todavia ainda há limitações, principalmente pela grande quantidade de doentes observados em uma epidemia. Portanto, o diagnóstico clínico é a principal ferramenta. Recentemente, pesquisadores das forças armadas americanas (US Army) descobriram um teste rápido para detecção do vírus de forma rápida em pools de insetos. É uma estratégia para a vigilância entomológica e pode ser um avanço futuro no diagnóstico em seres humanos (Link para o artigo).
As técnicas laboratoriais disponíveis agora são as seguintes:
1)Cultura viral - disponível em laboratórios de pesquisa, deve ser feita até 3 dias do início dos sintomas (período de viremia)
2)RT - PCR - disponibilidade limitada pelo custo e pela necessidade de pessoal e equipamento de maior custo, deve ser feita até 8 dias do início dos sintomas.
3)Detecção de anticorpos IgM por técnica imunoenzimática - teste mais disponível e capaz de detectar casos agudos, sua positividade se inicia a partir do quarto dia de doença.
4)Detecção de IgG - deve ser feita por meio de duas amostras (fase aguda e convalescência) para se avaliar o aumento de até quatro títulos de anticorpos séricos contra o vírus.
Vários Kits diagnóstico estão em fase de desenvolvimento e aprovação para uso clínico, enquanto isso deve-se contactar os agentes de saúde pública locais para informações acerca da disponibilidade dos exames e dos protocolos de aplicação.
No Brasil, o Ministério da Saúde publicou os seguintes documentos (links):
-Preparação e Resposta à Introdução do Vírus Chikungunya no Brasil
-CLASSIFICAÇÃO DE RISCO E MANEJO DO PACIENTE COM SUSPEITA DE CHIKUNGUNYA (FASE AGUDA)
-Febre de Chikungunya - Manejo Clínico
segunda-feira, maio 11, 2015
Dilemas morais e bioéticos
Foto do sítio bioethics.com
Atualmente, cada vez mais, a humanidade tem se deparado com esses dilemas. Um exemplo mais recente é o surto de ebola no oeste africano. A descoberta e o uso de novos medicamentos poderia salvar milhares de vidas, mas o preço a se pagar pelos excessos cometidos no passado e pelo avanço das novos delineamentos é a demora da sua liberação para uso clínico. Um artigo de opinião do Dr. Arthur Kaplan no Lancete desta semana levanta essa questão para discussão. Abaixo segue o link para a publicação:
Subscrever:
Comentários (Atom)
Origem da Quarentena - Quarantine origin
Em meados do século XIV, autoridades sanitárias da Itália, sul da França e arredores, premidos pela epidemia de peste negra, criaram um sist...
-
Muito se tem falado atualmente acerca do comportamento de uma epidemia. Principalmente pelo interesse e comoção social que se tem observado...
-
Figura - Regiões das Américas com relato de ocorrência de casos humanos de Febre de Oropouche (fonte: CAD. SAÚDE COLET., RIO DE JANEIRO, ...
-
Recentemente foi publicado no JN que o sarampo e a rubéola haviam sido eliminados em Portugal, apesar da utilização correta do conceito epi...